| Соединение | Молекулярная масса | Содержащие углерода в % в а. е. м. | |
| Сероуглерод | 76 | 15,79 | 12 |
| Диоксид углерода | 44 | 27,27 | 12 |
| Монооксид углерода | 28 | 42,86 | 12 |
| Ацетон | 58 | 62,07 | 36 |
| Диэтиловый эфир | 74 | 64,86 | 48 |
| Ацетилен | 26 | 92,31 | 24 |
| Бензол | 78 | 92,31 | 72 |
| Нафталин | 128 | 93,75 | 120 |
Наименьшая масса углерода, содержащегося в моле приведённых соединений равна 12 а. е. м. Следовательно атомная масса углерода не может быть больше 12 (иначе пришлось бы предположить, что в состав сероуглерода, диоксида и монооксида углерода входит часть атома углерода). Считать атомную массу углерода меньше 12, также нет оснований, так как соединения, содержащие менее 12 а. е. м. углерода, неизвестны.
Метод Менделеева. Атомную массу элемента можно рассчитать, исходя из положения этого элемента в Периодической системе. Приблизительную атомную массу элемента можно вычислить, как среднеарифметическое атомных масс соседних с ним элементов. Так, атомная масса алюминия, рассчитанная как среднеарифметическое атомных масс магния, кремния, бора и скандия:
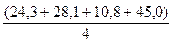 = 27,05
= 27,05
вполне удовлетворительно согласуется с табличной величиной 26,98. Разделив приблизительное значение атомной массы элемента на молярную массу его эквивалента, находят валентность элемента, округлив её до целочисленного значения, и затем, умножая эквивалентную массу на валентность элемента, находят его точную атомную массу.
Метод, основанный на законе Дюлонга и Пти. Французские учёные П. Дюлонг и А. Пти установили закон, согласно которому атомная теплоемкость простого вещества в твердом состоянии (т. е. произведение его удельной теплоемкости на молярную массу вещества) есть величина постоянная и равная в среднем 26 Дж/(К·моль).
Из закона Дюлонга и Пти следует, что разделив 26 на удельную теплоёмкость простого вещества, легко определяемую экспериментально, можно найти приблизительное значение атомной массы данного элемента.
Чтобы перейти от приблизительного значения атомной массы к точному её значению, предварительно определяют опытным путём эквивалентную массу данного элемента. Разделив приблизительное значение атомной массы на молярную массу его эквивалента, находят валентность элемента, часто несколько отличающуюся от целого числа. Так как валентность выражается только целыми числами, найденное значение округляют. Умножив эквивалентную массу на валентность, получают точное значение мольной массы атомов.
Пример 10. Определить молекулярную массу металла, удельная теплоёмкость которого равна 0,226 Дж/(г·К), а его оксид содержит 21,23% кислорода.
Вычислим приблизительное значение молярной массы атомов металла
М(Ме)»  = 115 г/моль
= 115 г/моль
значение эквивалентной массы металла:
21,23:78,77 = 8:х х = 78,77·8 / 21,23 = 29,68 (г/моль)
и валентность металла:
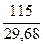 = 3,87
= 3,87
Так как валентность может выражаться только целым числом, полученное значение округляем до 4. Умножая эквивалентную массу на валентность, вычислим точное значение молярной массы атомов металла:
29,68 · 4 = 118,70 (г/моль)
По Периодической системе находим, что это олово.
 2020-10-11
2020-10-11 677
677








