Раздел химии, изучающий количественный состав и количественное соотношение между реагирующими веществами, называется стехиометрией.
ВВОДНАЯ ЛЕКЦИЯ
Химия - это наука, изучающая вещества, их состав, строение, свойства и взаимные превращения.
Основные положения атомно-молекулярной теории:
1. Все вещества состоят из молекул.
Молекула - это наименьшая частица вещества, обладающая его химическими свойствами.
2. Молекулы состоят из атомов.
Атом - это наименьшая частица элемента, обладающая его химическими свойствами.
Атом состоит из плотного, положительно заряженного ядра и отрицательно заряженных электронов. В целом атом электронейтрален.
Вид атомов с одинаковым зарядом ядра называется химическим элементом.
Атомы, обладающие одинаковым зарядом ядра, но разной массой, называются изотопами.
Так, природный хлор состоит из двух изотопов: 35Cl и 37Cl.
3. Молекулы и атомы находятся в непрерывном движении.
4. При химических реакциях молекулы одних веществ превращаются в молекулы других веществ. Атомы при химических реакциях не изменяются.
Вещества, молекулы которых состоят из атомов одного элемента - называются простыми веществами. Простые вещества могут иметь несколько аллотропных модификаций, т.е. вещества состоят из атомов одного и того же элемента, но обладают разными свойствами.
Сложными веществами называются вещества, молекулы которых состоят из разных элементов и в разных соотношениях.
Единицей измерения количества вещества в химии является моль.
Мольвещества - это количество вещества, содержащее столько структурных единиц (молекул, атомов, ионов) сколько содержится атомов в 12 г изотопа углерода 12С.
NA = 6,02×1023
Молярная (мольная) масса - это масса одного моль вещества (М).
[М] = [г / моль]
М Н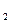 О = 18 г / моль, М NaOH = 40 г / моль
О = 18 г / моль, М NaOH = 40 г / моль
Молярный (мольный) объём - это объём одного моля газообразного вещества (Vм).
При нормальных условиях Vм = 22,4 л
Нормальные условия: p= 101325 Па, Т = 273К
ЗАКОН СОХРАНЕНИЯ МАССЫ.
Массы веществ, вступающих в реакцию, равны массе веществ, получающихся в результате реакции.
ЗАКОН ПОСТОЯНСТВА СОСТАВА.
Каждое сложное вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав. Следовательно, химические вещества взаимодействуют друг с другом в строго определенных (эквивалентных) соотношениях.
Эквивалент - это реальная или условная частица вещества, которая может присоединять, замещать, высвобождать один ион водорода в кислотно-основных и ионообменных реакциях или один электрон в окислительно-восстановительных реакциях.
Молярная масса эквивалентов - это масса одного моль эквивалентов, содержащая 6,02×1023 эквивалентов (Э).
[Э] = [г / моль×экв]
Эквивалент зависит от условий протекания реакций, а молярная масса - постоянна.
 2014-02-04
2014-02-04 521
521






