1. Принципы биоэнергетики клетки.
2. Пути и механизмы преобразования энергии в живых системах.
ОСНОВЫ БИОЭНЕРГЕТИКИ
Живые организмы представляют собой термодинамически неустойчивые системы. Для их формирования и функционирования необходимо непрерывное поступление энергии в форме, пригодной для многопланового использования. Поскольку временной масштаб биохимических превращений, восприятия и передачи сигналов, двигательных процессов таков, что за это время изменения внешнего давления и температуры незначительны, то с достаточной степенью точности биохимические процессы в живых организмах можно рассматривать как изобарно-изотермические. Поэтому в качестве термодинамической характеристики этих процессов можно использовать изменение изобарио-изотермпческого потенциала или энергии Гиббса ΔG. Интегрально любой процесс в таких системах может идти самопроизвольно только при уменьшении энергии Гиббса. Поэтому все многочисленные биохимические превращения, идущие с ее увеличением (энд-эргонические), должны протекать сопряженно с процессами, сопровождающимися уменьшением энергии Гиббса (экзэргоническпми), причем суммарный итог должен характеризоваться значением ΔG < 0.
Количественной термодинамической характеристикой химического процесса является величина ΔG0, представляющая собой изменение энергии Гиббса при протекании реакции при стандартных концентрациях компонентов - исходных веществ и продуктов реакции. Обычно в качестве таковых для растворителя принимают активность, равную единице, а для всех остальных компонентов - концентрации 1M. Следует при этом иметь в виду, что сама по себе величина ΔG0 еще не характеризует направление процесса, которое определяется знаком величины ΔG, связанной с ΔG0 соотношением
ΔG=ΔG0+RT1nП (8.1)
Здесь П - так называемое произведение реакции, равное отношению произведения концентраций (активностей) всех продуктов реакции в степенях, равных стехиометрическим коэффициентам этих продуктов в уравнении процесса, к такому же произведению для исходных веществ.
Однако, как видно из приведенного примера, стоящая под знаком логарифма величина является функцией активности ионов водорода, т.е. рН раствора, поскольку в биологически значимых условиях, т.е. в области значений рН, близких к 7, все три компонента находятся в частично ионизованном состоянии и доля неионизованных форм, входящих в выражение (8.2), невелика. Более того, эта доля по-разному изменяется для каждого из компонентов при изменении рН.
Значение ΔG0' дает достаточно хорошее представление о направлении биохимического процесса в нейтральной среде, если соотношения компонентов незначительно отличаются от стехиометрическпх и если процесс без учета ионов H+ и молекул воды идет без изменения числа частиц
Например, для реакции изомеризации глюкозо-6-фосфата во фруктозо-6-фосфат ΔG0' = 1,7 кДж/моль и в соответствии с этим при 250C (298 К)
К- ехр[-Δ ΔG0/(RT)] = 0,5 (8.6)
Следовательно, в равновесной смеси концентрация глюкозо-6-фосфата примерно в два раза превышает концентрацию фруктозо-6-фосфата Для реакции фосфорилирования глюкозы, протекающей по реакции
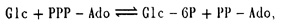
(VIII.2)
ΔG0= -16,7 кДж/моль и, следовательно, К = 850. Это означает, что в стехиометрической смеси при рН 7 отношение концентраций продуктов к концентрациям исходных веществ в равновесии составит √K = 29, т.е. реакция пройдет в сторону образования глюкозо-6-фосфата с выходом более чем 95%.
Если число частиц в реакции возрастает, то уменьшение абсолютных значений концентраций компонентов будет способствовать смещению равновесия в сторону продуктов реакции. Например, реакция превращения фруктозо-1,б-дифосфата в смесь глицеральдегид-3-фосфата и дигидроксиацетонфосфата характеризуется довольно высоким положительным значением величины ΔG0' = 23,8 кДж/моль. Однако при концентрациях компонентов 10-4M в стехиометрической смеси всех трех компонентов ΔG составит
ΔG = +23,8 + RT1n(10-4) = 23,8 - 22,8 = 1 кДж/моль, (8.7)
т.е. близко к нулю. В равновесной смеси при этом будут присутствовать соизмеримые количества исходного вещества и продуктов реакции.
Большое число важных для биоэнергетики процессов являются окислительно-восстановительными. Для таких процессов наряду со значением ΔG0 можно использовать величину ΔE0 - стандартную разность окислительно-восстановительных потенциалов для двух сопряженных пар окислитель-восстановитель, участвующих в превращении. Связь между этими величинами имеет вид
ΔE0=ΔG0/(nF), (8.8)
где n - число электронов, переносимых от восстановителя к окислителю; F - постоянная Фарадея.
Удобство такого представления прежде всего состоит в том, что появляется возможность характеризовать относительные окислительные, а следовательно, и восстановительные свойства каждой сопряженной пары и тем самым расположить их в определенный ряд в порядке убывания потенциала Е°. Величина ΔE0 для любого процесса получается в виде разности величин E0 для каждой из двух участвующих в процессе пар.
Так же как и для значений ΔG0, в биохимии принято пользоваться величинами E0, полученными для стандартного состояния, соответствующего рН 7.
Принципы биоэнергетики клетки.
Биоэнергетика клетки представляет собой совокупность процессов превращения энергии в биологических системах: извлечение энергии из окружающей среды, аккумулирование и использование для жизнедеятельности клетки. В основе биоэнергетики лежат законы физики и химии, приложимы законы термодинамики.
Метаболизм веществ и энергии представляет собой совокупность процессов превращения веществ и энергии в живой клетке, а также между клеткой и окружающей средой. С точки зрения биоэнергетики метаболизм подразделяется на катаболизм – совокупность биохимических реакций, связанных с извлечением химической энергии, аккумулированной в расщепляемом соединении, и анаболизм – её использование.
Основные функции метаболизма:
1. Извлечение энергии из окружающей среды путём распада поступивших в клетку органических соединений или поглощения квантов света с образованием высокоэнергетических соединений, в количестве, достаточном для обеспечения всех энергетических потребностей клетки.
2. использование энергии для синтеза эндогенных соединений (или для транспорта уже готовых соединений в клетку), являющихся предшественниками макромолекулярных компонентов клетки; для совершения работы (осмотической, электрической, механической).
3. Синтез из предшественников структурных компонентов клетки (белков, нуклеиновых кислот, углеводов, липидов и других соединений), а также их распад и обновление.
4. Синтез и распад биомолекул со специальным назначением (гормоны, ферменты).
Клетку можно представить как изолированную изотермическую систему (поддерживается постоянство температуры и давления).
Раздел биохимии изучающий энергетику клетки называется биохимическая термодинамика. Основная задача: изучение взаимоотношений между химической и другими формами энергии.
Основные понятия биохимической термодинамики:
Система - совокупность веществ, подлежащих изучению. Всё что не входит и находится за пределами системы – окружающая среда.
Характеристику перехода системы из одного состояния в другое можно представить следующими термодинамическими функциями: внутренняя энергия, энтальпия, энтропия, свободная энергия. В основном имеют место работа с изменениями функций системы.
Внутренняя энергия представляет собой полную энергию системы. Определяется только состоянием системы в данный момент и не зависит от предыстории системы.
Энтальпия – теплосодержание системы. В классической термодинамике
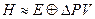
где PV- работа системы, связанная с изменением давления и объема.
Поскольку реакции протекают при неизменном давлении и в мало изменяющемся объеме системы разница между внутренней энергией и энтальпией пренебрежимо мала.
Энтропия – функция системы, которая характеризует степень неупорядоченности системы.
S = k*lnW,
k – газовая постоянная на одну молекулу (R деленная на число Авогадро).
W – термодинамическая вероятность, число энергетических уровней, которыми обладает молекула.
С повышением температуры энтропия возрастает. С понижением температуры W уменьшается, при абсолютном нуле становится равным единице.
Свободная энергия биохимических реакций представляет собой часть внутренней энергии клетки, которая может быть превращена в полезную работу химического синтеза, механического движения, транспорта веществ и т.д.
Высокоэнергетические соединения занимают центральное положение в превращениях веществ и энергии клетки. Химическая связь в таких соединениях носит название макроэргической связи. Вокруг нее и локализована свободная энергия. Разрыв высокоэнергетической связи всегда сопровождается отщеплением от высокоэнергетического соединения химической группы и переносом на его молекулу какого-либо акцептора.
К важнейшим веществам такой природы относятся обширный класс фосфорорганических соединений, включающий в себя ангидриды фосфорной кислоты, ацилфосфаты, гуанидинфосфаты. К высокоэнергетическим соединениям относятся также ряд тиоловых эфиров и эфиров аминокислот. Центральное место занимает АТФ – аденозинтрифосфат.
АТФ, АДФ и АМФ образуют адениловую систему. АТФ образуется в ходе эндергонической реакции – реакции фосфорилирования.
АДФ + H3PO4 → АТФ
В этой реакции используется либо энергия, извлекаемая при окислении фрагментов питательных веществ, связанном с субстратным фосфорилированием, либо энергия, выделяющаяся при переносе электронов по дыхательной цепи, сопряженном с окислительным фосфорилированием, либо энергия, получаемая за счет фотосинтетического фосфорилирования.
 2014-02-04
2014-02-04 4759
4759







