Первый принцип термодинамики
Теплота, сообщаемая системе, тратится на изменение её
внутренней энергии и на работу, совершаемую системой над средой.
Q=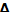 U+p
U+p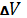 инт.
инт.
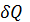 =dU+P
=dU+P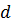 V диф.
V диф.
1) Изохорный процесс
V=const
dV=0
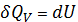
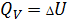
Вся теплота тратится на превращение внутренней энергии.
2) Изобарный процесс
P=const
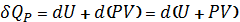
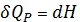
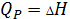
3) Адиабатный процесс
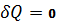
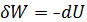
W=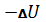
Работа тратится на убыль внутренней энергии.
4) Изотермический процесс
T=const
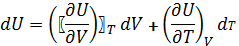
dU=0
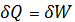
Вся теплота превращается в работу.
Теплоёмкость.
Это количество теплоты необходимой для увеличения температуры системы на 1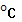 .
.
Различают удельную и молярную теплоёмкость.
 отношение количества теплоты подведённое к 1г. вещества.
отношение количества теплоты подведённое к 1г. вещества.

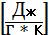

тепл. подведённой к 1 моль вещества на разницу температур.
Для бесконечно малых величин можно записать:
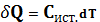

Истинная теплоёмкость это отношение бесконечно малого количества теплоты к бесконечно малому превр. температуры.
Большинство процессов проводят при V=const, P=const
V=const
 (изохорн. молярн. теплоёмкость)
(изохорн. молярн. теплоёмкость)
P=const
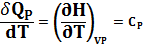 (изоб. теплоёмкость)
(изоб. теплоёмкость)
Находим разницу между 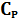 и
и 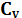


dU=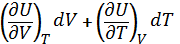

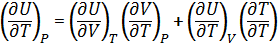
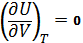
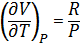

1) Для одноатомного газа


2) Для двухатомного газа


Зависимость теплоёмкости чистых веществ от темп. выраж. в виде темпер. ряда.
Для органических веществ:
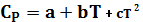
Лекция №3.
 2014-02-05
2014-02-05 567
567








