АТОМНО-КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА МЕТАЛЛОВ
Тема № 1
Под металлами понимают определенную группу элементов, расположенную в левой части Периодической таблицы Д.И.Менделеева.
Особенность строения металлических веществ заключается в том, что они все построены в основном из таких атомов, у которых внешние электроны слабо связаны с ядром. Это обусловливает и особый характер химического взаимодействия атомов металла, и металлические свойства.
Теория металлического состояния рассматривает металл как вещество, состоящее из положительно заряженных ионов, окруженных отрицательно заряженными частицами - электронами, слабо связанными с ядром. Эти электроны непрерывно перемещаются внутри металла и принадлежат не одному какому-то атому, а всей совокупности атомов.
Характерной особенностью атомно-кристаллического строения металлов является наличие электронного газа внутри металла, слабо связанного с положительно заряженными ионами.
Все металлы можно разделить на две большие группы - черные и цветные металлы.
Черные металлы имеют темно-серый цвет, большую плотность (кроме щелочноземельных), высокую температуру плавления, относительно высокую плотность и во многих случаях обладают полиморфизмом. Наиболее типичным металлом этой группы является железо.
Цветные металлы чаще всего имеют характерную окраску: красную, желтую, белую. Обладают большой пластичностью, малой твердостью, относительно низкой температурой плавления, для них характерно отсутствие полиморфизма. Наиболее типичным металлом этой группы является медь.
Текже металлы можно подразделить следующим образом:
1. Железные металлы - железо, кобальт, никель и близкий к ним по своим свойствам марганец. Кобальт, никель и марганец часто применяют как добавки к сплавам железа, а также в качестве основы для соответствующих сплавов, похожих по своим свойствам на высоколегированные стали.
2. Тугоплавкие металлы, температура плавления которых выше, чем железа (т.е. 1539 С). Применяют как добавки к легированным сталям, а также в качестве основы для соответствующих сплавов.
3. Редкоземельные металлы (РМЗ) - лантан, церий, неодим, празеодим и др., объединяемые под названием лантаноидов, и сходные с ними по свойствам иттрий и скандий.
4. Щелочноземельные металлы в свободном металлическом состоянии не применяются, за исключением специальных случаев.
Цветные металлы подразделяются на:
1. Легкие металлы - бериллий, магний, алюминий, обладающие малой плотностью.
2. Благородные металлы - серебро, золото, металлы платиновой группы.
3. Легкоплавкие металлы - цинк, кадмий, ртуть, олово, свинец, висмут, таллий, сурьма и элементы с ослабленными металлическими свойствами - галлий, германий.
Всякое вещество может находится в трех агрегатных состояниях -твердом, жидком и газообразном.
Кристаллическое состояние прежде всего характеризуется определенным, закономерным расположением атомов в пространстве.
В кристалле каждый атом имеет одно и то же количество ближайших атомов - соседей, расположенных на одинаковом от него расстояние.
Расположение атомов в кристалле изображается в виде пространственных схем, в виде так называемых кристаллических ячеек. Под элементарной кристаллической ячейкой подразумевается наименьший комплекс атомов, который при многократном повторение в пространстве позволяет воспроизвести пространственную кристаллическую решетку.
 |
Простейшим типом кристаллической ячейки является кубическая решетка. В простой кубической решетке атомы расположены (упакованы) недостаточно плотно.
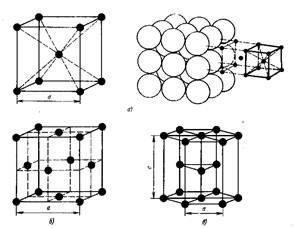
Рис.1. Типы кристаллической ячейки:
а - кубическая объемно-центрированная, б – кубическая гранецентрированная; с - гексагональная плотноупакованная
Стремление атомов металла занять места, наиболее близкие друг к другу, приводят к образованию решеток следующих типов (рис. 1): кубической объем-ноцентрированной, кубической гранецентрированной и гексагональной плотноупакованной (рис.1).
В кубической объемно-центрированной решетки (ОЦК) атомы расположены в углах куба и один атом в центре объема куба. в гранецентрированной кубической решетке (ГЦК) -атомы расположены в углах куба и в центре каждой грани, в гексагональной решетке атомы расположены в углах и центре шестигранных оснований призмы и три атома в средней плоскости призмы.
Кубическую ОЦК решетку имеют металлы:Na, Li, W, V, Cr и др. Кубическую ГЦК решетку имеют Pb, Ni, Ag, Au, Cu и др.
Размеры кристаллической решетки характеризуются параметрами, или периодами решетки. Кубическую решетку определяет один параметр - длина ребра куба. Параметры имеют величины порядка атомных размеров и измеряются в ангстремах.
Некоторые металлы имеют тетрагональную решетку; она характеризуется тем, что ребро с не равно ребру а. Отношение этих параметров характеризует так называемую степень тетрагональности. Число атомов, находящихся на наиболее близком расстояние от данного атома, называется координационным числом. Так например, атом в простой кубической решетке имеет шесть ближайших равноотстоящих соседей, т.е. координационное число этой решетки равно 6 (рис. 2).
Центральный атом в объемноцентрированной решетке имеет восемь ближайших равноотстоящих соседей, т.е. координационное число этой решетки равно 8. Координационное число для гранецентрированной решетки равно 12. В случае гексагональной плотноупакованной решетки координационное число равно 12.
 2014-02-02
2014-02-02 820
820







