Диаграммы состояния, или диаграммы фазового равновесия в графической форме показывают фазовый состав сплава в зависимости от температуры и концентрации. Диаграммы состояния строят для условий равновесия или условий, достаточно близких к ним. (Равновесное состояние соответствует минимальному значению свободной энергии. Это состояние может быть достигнуто только при очень малых скоростях охлаждения или длительном нагреве. В связи с этим рассмотрение диаграмм состояния позволяет определить фазовые превращения в условиях очень медленного охлаждения или нагрева. Истинное равновесие в практических условиях достигается редко).
Фаза – часть системы, характеризующаяся определенным химическим составом, структурой (для твердых фаз – атомно-кристаллической решеткой), свойствами и отделенная от остальных фаз границей раздела при переходе через которую, свойства скачкообразно изменяются.
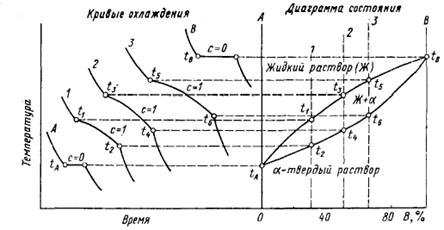
Для экспериментального построения диаграммы состояний сплавов, образованных компонентами А и В, необходимо изготовить серию сплавов, содержащих различные количества компонентов А и В. Для каждого такого сплава экспериментально строят кривые охлаждения и определяют по ним критические точки, т. е. температуры фазовых превращений. Полученные значения критических точек изучаемых сплавов откладывают на вертикальных линиях, соответствующих химическому составу этих сплавов. Затем соединяют критические точки, соответствующие определенным фазовым превращениям и получают линии диаграммы состояний.
 | 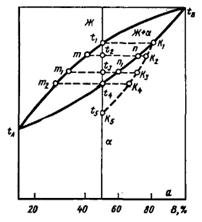 |
| Полная взаимная растворимость компонентов |
Правило фаз устанавливает температурные условия процесса кристаллизации при заданном давлении, а также определяет, сколько фаз должно быть в чистом компоненте или в сплаве определенного состава, если они находятся в равновесном состоянии при данной температуре (или давлении). Равновесное фазовое состояние сплава определяется составом фаз, температурой и давлением.
Число факторов, которые можно менять, не изменяя фазового состава сплава, называют степенью свободы. Степень свободы (с) определяется числом компонентов (к) и числом фаз (Ф), имеющихся в сплаве при данной температуре и давлении:
с = к + 2 – Ф.
Обычно диаграммы состояний строят для постоянного (атмосферного) давления. В этом случае формула принимает вид: с = к + 1 – Ф.
Следовательно, в двойной системе в равновесии может находиться не больше трех фаз, в тройной – не больше четырех и т. д. Если в равновесии в системе с определенным числом компонентов находится максимальное число фаз, то число степеней свободы системы равно нулю (С = 0). Такое равновесие называют нонвариантным (безвариантным). При нонвариантном равновесии, сплав из данного числа фаз может существовать только в совершенно определенных условиях: при постоянной температуре и определенном составе всех находящихся в равновесии фаз. Это означает, что превращение начинается и заканчивается при одной постоянной температуре.
 2014-02-02
2014-02-02 1345
1345
