Строение вещества определяется характером движения и взаимодействия атомов и молекул его составляющих и, в конечном итоге, типом и силой химических связей, образованных в результате их взаимодействия.
Атом водорода состоит из объединенных электрона и протона. Установлено, что электрон в атоме водорода вблизи ядра обладает меньшей энергией, чем на бесконечном удалении от него (этот уровень принимают за нуль). Минимум энергии достигается как своего рода компромисс между кинетической и потенциальной энергией и очень важно, что этот минимум действительно существует. В поисках минимума энергии электрон стремиться быть ближе к ядру.
А будут ли стремиться сблизиться два атома водорода, чтобы уменьшить суммарную энергию? Действительно, они сближаются и в результате образуют молекулу водорода. Такое объединение атомов называют химической связью, которые изучает химия.
Химическую связь можно объяснить, только опираясь на электрические и некоторые квантовые явления. И в таком положении находится не только химия, но и, например, металлургия. Если большое число атомов, собравшись вместе, образуют твердое тело, то причину этого надо опять искать в особенностях поведения электронов. Поэтому все механические свойства твёрдых тел, включая твёрдость и высокую прочность, исходят из электрически свойств тех компонентов, из которых они состоят.
Прежде чем говорить о видах химических связей, коснемся некоторых общих вопросов о характере сил, которые участвуют в образовании химической связи.
Во-первых, это должны быть силы притяжения. На эту роль претендуют силы кулоновского притяжения разноимённых зарядов. Эти силы убывают пропорционально квадрату расстояния между зарядами.
Например, хорошо известно, что натрий легко отдаёт свой внешний (так называемый, валентный) электрон е- и превращается в положительный ион Na+. С другой стороны хлор с легкостью присоединяет е-. Поэтому, е-, покинувший атом натрия, попадает на оболочку атома хлора. В результате образуются положительно заряженный ион натрия и отрицательно заряженный ион хлора СL-. Эти два иона притягиваются друг к другу. Однако пока не ясно, почему молекула NaCL существует в виде устойчивой структуры с расстоянием между Na и CL, равным 0,28 нм. Что препятствует дальнейшему сближению? Ведь кулоновские силы непрерывно возрастают с уменьшением расстояния между зарядами. Это верно, но между ионами действуют не только силы электростатической природы. Если ионы сближаются так, что их электронные оболочки начинают заметно искажаться, то возникают силы, препятствующие этому. Эти отталкивающие силы возникают на малых расстояниях и вступают в игру только тогда, когда расстояние между ионами соизмеримо с размерами атомов. Таким образом, существуют два вида сил, противоположных по характеру воздействия на ионы. Равновесие между ними определяет стационарное значение расстояния между ионами r0.
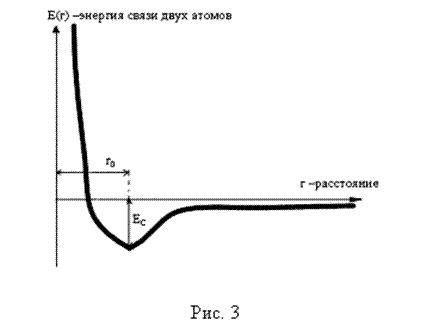
Рис. 2.2.
Если построить зависимость суммарной энергии двух атомов от расстояния, то он будет выглядеть примерно так, как показано на 2.2.. Из этого рисунка следует:
1. Энергия стремится к нулю с увеличением расстояния между ионами; другими словами, нулевая энергия соответствует полному отсутствию взаимодействия.
2. На больших расстояниях энергия отрицательна и убывает с уменьшением r; это означает, что области r > r0 ионы притягиваются.
3. При очень малых расстояниях энергия очень быстро возрастает, т.е. ионы отталкиваются, если r < r0.
4. Функция имеет минимум в точке r0, которая соответствует состоянию равновесия; здесь сила притяжения в точности равна силе отталкивания.
Теперь если при помощи внешней силы кристалл сжимать и уменьшать поэтому расстояние между атомами, то в соответствии с приведенной на рис.3 моделью, энергия системы будет увеличиваться. Следовательно, если внешнюю силу снять, то кристалл вернется в исходное состояние. В технике это свойство твердого тела называют упругостью. Таким образом, если зависимость E(r) известна, то можно определить все упругие свойства кристалла.
Межатомная связь возникает благодаря тому, что атомы в веществе расположены близко друг к другу (Рис. 2.3.)
 2014-02-02
2014-02-02 512
512








