Из периодической системы элементов Д.И.Менделеева находим, что атом Si на уровне 3р имеет два электрона и вакансии для четырех электронов. Каждый атом Si в твердом состоянии стремится притянуть по одному е- от каждого из
четырех соседних атомов для того, чтобы иметь заполненную оболочку 3р. Поскольку не существует преимущественного выбора атомов, каждый атом Si стремится дополнить свои два 3s - электрона и два 3р электрона в такой же мере, как и соседние атомы.
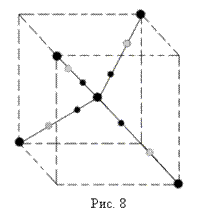
Если кремний находится в твердом состоянии, его атомы расположены в пространстве некоторым регулярным образом и образуют кристаллическую структуру. Трехмерная картина ковалентных связей изображена на рис. 8.
В том случае, когда валентные е- участвуют в образовании связи, как это показано на рис., вещество ведет себя подобно диэлектрику (для Si это наблюдается при Т0 около 00К). Приток тепловой (с???????????? Т0) или лучистой энергии разрывает ковалентные связи, освобождая электроны. Энергия, необходимая для разрыва одной связи в атоме Si составляет примерно 1.1 эВ! Связь атома Si с четырьмя соседними атомами (черными кружками изображены 4 валентных е- принадлежащих центральному атому, светлые - е-, принадлежащие и соседним атомам).
Молекулярная связь (связь Ван-дер-Ваальса ) возникает у веществ между молекулами с ковалентным характером внутримолекулярного взаимодействия при согласованном движении валентных электронов в соседних молекулах. Молекулярные связи существуют между отдельными молекулами за счет электростатического притяжения имеющимися в них зарядами противоположных знаков (силы Ван-дер-Ваальса). Эти связи удерживают вместе молекулы в твердом водороде (H2), азоте (N2), углекислом газе (СО2), во многих органических соединениях — полиэтилене, политетрафторэтилене и т. д. Ввиду слабости молекулярных связей эти вещества легко разрушаются при тепловом движении молекул и имеют низкие температуры плавления и кипения.
Особым видом молекулярной связи является водородная связь, осуществляемая через ион водорода (протон), расположенный между двумя ионами (О2–, F–, С1–) соседних молекул. Водородная связь имеется в воде Н2О и некоторых органических соединениях, а также в кристаллах типа КН2Р04.
 2014-02-02
2014-02-02 1835
1835
