Литература
Основная:
1. Артеменко А.И. Органическая химия. – М.: «Высшая школа», 2003. – 605 с.
Дополнительная:
3. Артеменко А.И. Органическая химия. – М.: «Высшая школа», 1987. – 430 с.
Краткое содержание лекции
Значение и применение полимеров непредельных углеводородов в различных отраслях промышленности очень важно.
Алкены, или олефины* - алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна двойная связь.
Алкены содержат в соей молекуле меньшее количество водородных атомов, чем соответствующие им алканы (с тем же числом углеродных атомов), поэтому такие углеводороды называют непредельными или ненасыщенными.
Простейшим представителем этиленовых углеводородов, его родоначальником является этилен (этен) С2Н4. строение его молекулы можно выразить структурной формулой:
Н Н
\ /
С = С
/ \
Н Н
В молекуле этилена, в отличие от молекул предельных углеводородов, атом углерода находится во втором валентном состоянии, т.е. в состоянии sp 2-гибридизации. В этом случае одна из трех sp 2-гибридных орбиталей перекрывается с такой же орбиталью второго углеродного атома. В результате образуется углерод-углеродная σ-связь. Две другие гибридные орбитали углеродных атомов, перекрываясь с 1s-орбиталями атомов водорода, образуют четыре σ-связи С-Н. Они расположены относительно друг от друга под углом 120°. В то же время каждый из углеродных атомов в состоянии sp 2-гибридизации сохраняет еще по одной неизменной (негибридизованной) 2 р - орбитали. Их оси расположены перпендикулярно плоскости гибридных орбиталей (рис. 12). Перекрываясь друг с другом, эти орбитали образуют качественно новую связь – π-связь.
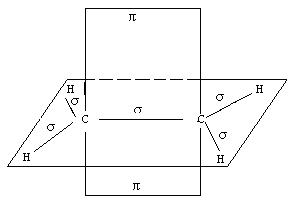
Рис. 12. Схема расположения σ- и π-связей в молекуле этилена
Номенклатура. По систематической номенклатуре родовое название этиленовых углеводородов – алкены. Названия отдельных гомологов по этой номенклатуре производят заменой суффикса –ан в соответствующих алканах на суффикс –ен (этан – этен, пропан – пропен, бутан – бутен и т.д.). выбор главной цепи и порядок названия сохраняются те же, что и для алканов. Однако в состав цепи должна обязательно включатся двойная связь. Нумерацию цепи начинают с того конца, к которому ближе расположена эта связь. Например:
5 4 3 2 1 4
Н3С – СН – СН = СН – СН3 Н3С
| \3 2 1
СН3 СН – С = СН2
/ |
Н3С СН3
4-метилпентен-2 2,3-диметилбутен-1
Получение. Из лабораторных способов получения можно отметить следующие:
1. Отщепление галогеноводорода от галогеналкилов при действии на них спиртового раствора щелочи (реакция элиминирования)
Н2С – СН2 → Н2С = СН2 + КСl + H2O
| |


-
2. Гидрирование ацетилена в присутствии катализатора (Pd)
H – C ≡ C – H + H2 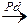 Н2С = СН2
Н2С = СН2
3. Дегидратация спиртов. В качестве катализатора используют кислоты (серную или фосфорную) или Al2O3 при нагревании (350 – 400 °C)
| |
 |
этиловый спирт
Химические свойства. Алкены в отличии от алканов обладают высокой химической активностью. Их свойства определяются двойной углерод-углеродной связью, состоящей из σ-и π-связей. π-Связь как наименее прочная и более доступная при действии реагента разрывается, а освободившиеся валентности атомов углерода затрачиваются на присоединение атомов, из которых состоит молекула реагента:
| |||
|
\ / \ /
С = С + А – В → С – С
|
А В
Из этой схемы видно, что двойная связь разрывается как бы наполовину: σ-связь сохраняется, а π-связь переходит в две одинарные σ-связи (С-А и С-В). Таким образом, для алкенов наиболее типичны реакции присоединения. Алкены вступают также в реакции полимеризации и окисления.
Диеновые углеводороды (алкадиены, или диолефины)
Диеновые углеводороды (алкадиены, или диолефины) – непредельные органические соединения, содержащие в молекуле две двойные связи.
Номенклатура. По систематической номенклатуре диеновые углеводороды называют, как и этиленовые, но заменяют суффикс –ен на - диен (две двойные связи). Нумерацию углеродных атомов производят так, чтобы сумма цифр, обозначающих положение двойных связей, была наименьшей:
1 2 3 4 5 1 2 3 4 5 6 7
Н2С = СН – СН = СН – СН3 Н2С – СН = СН – С = СН – СН2 – СН3
|
СН3
пентадиен-1,3 4-метилгептадиен-2,4
(но не пентадиен-2,4) (но не 4-метилгептадиен-3,5)
В систематической номенклатуре сохраняются такие тривиальные названия, как аллен (пропадиен-1,2), дивинил (бутадиен-1,3), изопрен (2-метилбутадиен- 1,3).
Изомерия. Изомерия диенов зависит от различного положения двойных связей в углеродной цепи и от строения углеродного скелета. Например, для диена с молекулярной формулой С5Н8 возможны следующие изомеры:
Н2С = С - СН = СН2 Н3С – С = С= СН2 Н3С – СН = С = СН – СН3
| |
СН3 СН3
2-метилбутадиен-1,3 3-метилбутадиен-1,2 пентадиен-2,3
Н2С=СН–СН2–СН=СН2 Н2С=С=СН–СН2–СН3 Н2С=СН–СН=СН-СН3
пентадиен-1,4 пентадиен-1,2 пентадиен-1,3
Отдельные представители. Дивинил (бутадиен-1,3) Н2С = С - СН = СН2– бесцветный газ с резким неприятным запахом, сжижающийся при -4,5°C. Служит одним из важнейших исходных веществ (мономеров) для производства синтетических каучуков и латексов, пластмасс и других органических соединений.
Изопрен (2-метилбутадиен-1,3) Н2С = С(СН3) - СН = СН2 – бесцветная жидкость с т. кип. 34,1°C. Является структурной составляющей природного каучука и других соединений (терпенов, каротиноидов и др.). Применяется для получения синтетического каучука.
Хлоропрен (2-хлорбутадиен-1,3) Н2С = С(Сl) - СН = СН2 – бесцветная токсичная жидкость. В качестве сырья для получения хлоропрена используют винилацетилен Н2С = СН – С ≡ СН. Его применяют для производства хлоропренового синтетического каучука.
2,3-Диметилбутадиен -1,3 Н2С = С(СН3) – С(СН3) = СН2 – жидкость, кипящая при 69,6°C. Легко полимеризуется с образованием «метилкаучука».
Непредельные углеводороды ряда ацетилена (алкины)
Алкины (ацетилены) – алифатические непредельные углеводороды, в молекулах которых между атомами углерода имеется одна тройная связь.
Алкины являются еще более непредельными соединениями, чем соответствующие им алкены (с тем же числом углеродных атомов). Это видно из сравнения числа атомов водорода в ряду:
С2Н6 С2Н4 С2Н2
этан этилен ацетилен
Алкины образуют гомологический ряд с общей формулой CnH2n-2. Эта формула является общей и для гомологического ряда диеновых углеводородов. Таким образом, алкины и алкадиены – изомеры. Например, для углеводорода с молекулярной формулой С3Н4 возможны два изомерных соединения, одно из которых относится к диеновым углеводородам, а другое – к алкиновым:
Н2С = С= СН2 Н3С – С ≡ СН
пропадиен-1,2 пропин
Строение. Первым и основным представителем гомологического ряда алкинов является ацетилен (этин) С2Н2. Строение его молекулы можно выразить структурной (I) или электронной (II) формулой:
Н – С ≡ С - Н или Н:С ::: С:Н
I II
В алкинах атомы углерода находятся в третьем валентном состоянии (sp - гибридизация). В этом случае между углеродными атомами возникает тройная связь, состоящая из одной σ- и двух π-связей (рис. 13).
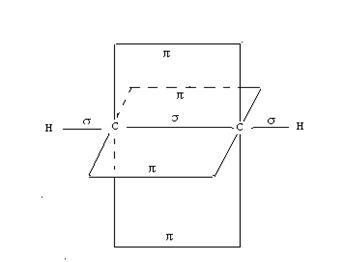
Рис. 13. Схема взаимного расположения σ- и π-связей в молекуле ацетилена
Номенклатура. По названию первого представителя гомологического ряда алкинов – ацетилена – эти углеводороды называют ацетиленовыми.
По систематической номенклатуре алкины называют, заменяя суффикс –ан (в алканах) на суффикс –ин. В состав главной цепи обязательно включают тройную связь, которая определяет начало нумерации. Если молекула непредельного углеводорода содержит одновременно двойную и тройную связи, то предпочтение в нумерации отдают двойной связи:
Н-С≡СН2-СН3 Н3С-С≡С-СН3 Н2С=С-СН2-С≡СН
|
СН3
бутин-1 бутин-2 2-метилпептен-1-ин-4
(этилацетилен) (диметилацетилен)
Химические свойства. Химические свойства алкинов определяются тройнойсвязью и особенностью ее строения. Алкины способны вступать в реакцииприсоединения, замещения, полимеризации и окисления.
Cабактың кыскаша мазмұны
Өндірістік әртурлі салаларында қанықпаған көмірсутектердің негізінде алынган полимерлердің кеңінен қолданыс табуда.
Лекцияда алкен, алкадиен, алкиндердің кұрылысы, номенклатура мен изомериялары жене кейбір химиялык касиеттері карастырылады. Алкандарға қарағанда қанықпаған кемірсутектердің химиялық белсенілігі жоғары. Алкендердің химиялық қасиеті 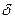 - жэне
- жэне 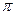 - байланыстардан туратын кеміртек –көміртек байланысымен, ал алкиндерде үшбайланыс 6ip
- байланыстардан туратын кеміртек –көміртек байланысымен, ал алкиндерде үшбайланыс 6ip 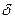 - және екі -
- және екі - 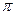 -байланыстардан тұратын көміртек атомдары анықтайды.
-байланыстардан тұратын көміртек атомдары анықтайды.
 2014-02-02
2014-02-02 985
985








