Рис. 2
Первоначально предполагалось, что спин обусловлен вращением электрона вокруг своей оси. Позднее было показано, что спин имеет квантовую природу. Спин следует считать внутренним свойством, присущим электрону, подобно тому, как ему присущ и заряд и масса.
Собственный момент импульса электрона LS (спин) выражается через спиновое квантовое число s равное 1/2, т.е. спин квантуется по закону
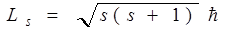 .
.
Проекция спина на заданное направление z может принимать два квантованных значения
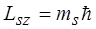 ,
,
где ms = ± s = ± 1/2 называют магнитным спиновым квантовым числом или просто спиновым квантовым числом, т.е. также как и s.
Итак, состояние каждого электрона в атоме характеризуется четырьмя квантовыми числами:
1. Главное квантовое число n (n = 1, 2... ¥).
2. Орбитальное (азимутальное) квантовое число l (l = 0, 1, 2,... n-1)
3. Магнитное квантовое число m (m = 0, ± 1, ± 2, ±... ± l)
4. Спиновое квантовое число ms (ms = ± 1/2).
Для одного фиксированного значения главного квантового числа n существует 2 n 2 различных квантовых состояний электрона.
Один из законов квантовой механики, называемый принципом Паули, утверждает:
В одном и том же атоме не может быть двух электронов, обладающих одинаковым набором квантовых чисел, (т.е. не может быть двух электронов в одинаковом состоянии).
Принцип Паули дает объяснение периодической повторяемости свойств атома, т.е. периодической системе элементов Менделеева.
 2014-02-02
2014-02-02 672
672








