Термолябильность - зависимость активности ферментов от температуры. При повышении температуры от 0 до 40 градусов активность ферментов растёт согласно правилу Вант-Гоффа (при возрастании температуры на 10 градусов скорость реакции увеличивается в 2 – 4 раза). При дальнейшем повышении температуры активность ферментов начинает снижаться, что объясняется тепловой денатурацией белковой молекулы фермента. Графически термозависимость ферментов имеет вид:
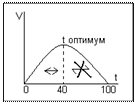 Инактивация фермента при 0 градусов обратима, а при высокой температуре инактивация приобретает необратимый характер. Это свойство ферментов определяет максимальную скорость реакции в условиях температуры тела человека. Термолябильность ферментов должна учитываться в практической медицинской деятельности. Например, при проведении ферментативной реакции в пробирке, необходимо создавать оптимальную температуру. Это свойство ферментов может быть применено в криохирургии, когда сложная длительная операция проводится при снижении температуры тела, что замедляет скорость протекающих в организме реакций, снижает потребление кислорода тканями. Хранить ферментативные препараты необходимо при пониженной температуре. Для обезвреживания, обеззараживания микроорганизмов используют высокие температуры (автоклавирование, кипячение инструментария).
Инактивация фермента при 0 градусов обратима, а при высокой температуре инактивация приобретает необратимый характер. Это свойство ферментов определяет максимальную скорость реакции в условиях температуры тела человека. Термолябильность ферментов должна учитываться в практической медицинской деятельности. Например, при проведении ферментативной реакции в пробирке, необходимо создавать оптимальную температуру. Это свойство ферментов может быть применено в криохирургии, когда сложная длительная операция проводится при снижении температуры тела, что замедляет скорость протекающих в организме реакций, снижает потребление кислорода тканями. Хранить ферментативные препараты необходимо при пониженной температуре. Для обезвреживания, обеззараживания микроорганизмов используют высокие температуры (автоклавирование, кипячение инструментария).
Фотолябильность.
Фотолябильность - зависимость активности ферментов от действия ультрафиолетовых лучей. УФЛ вызывают фотоденатурацию белковых молекул и уменьшают активность ферментов. Это свойство ферментов используют в бактерицидном эффекте ультрафиолетовых ламп.
Зависимость активности от рН.
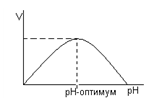 У всех ферментов есть определённый интервал рН, в котором активность фермента максимальна - оптимум рН. Для многих ферментов оптимум около 7. В то же время, для пепсина оптимальная среда 1-2, для щелочной фосфатазы около 9. При отклонении рН от оптимума активность фермента снижается, что видно из графика. Это свойство ферментов объясняется изменением ионизации ионогенных групп в молекулах фермента, что ведёт к изменению ионных связей в молекуле белковой молекулы фермента. Это сопровождается изменением конформации молекулы фермента, а это, в свою очередь, приводит к изменению его активности. В условиях организма рН - зависимость определяет максимальную активность ферментов. Это свойство находит и практическое применение. Ферментативные реакции вне организма проводятся при оптимуме рН. При сниженной кислотности желудочного сока с лечебной целью назначают раствор НСl.
У всех ферментов есть определённый интервал рН, в котором активность фермента максимальна - оптимум рН. Для многих ферментов оптимум около 7. В то же время, для пепсина оптимальная среда 1-2, для щелочной фосфатазы около 9. При отклонении рН от оптимума активность фермента снижается, что видно из графика. Это свойство ферментов объясняется изменением ионизации ионогенных групп в молекулах фермента, что ведёт к изменению ионных связей в молекуле белковой молекулы фермента. Это сопровождается изменением конформации молекулы фермента, а это, в свою очередь, приводит к изменению его активности. В условиях организма рН - зависимость определяет максимальную активность ферментов. Это свойство находит и практическое применение. Ферментативные реакции вне организма проводятся при оптимуме рН. При сниженной кислотности желудочного сока с лечебной целью назначают раствор НСl.
 2014-02-02
2014-02-02 1179
1179
