Что атомные ядра имеют размеры примерно 10 –14 – 10 –15 м (линейные размеры атома примерно 10 -10 м), впервые показал Резерфорд.
Атомное ядро состоит из элементарных частиц протонов и нейтронов (протонно-нейтронная модель ядра была предложена советским физиком Д. Л. Иваненко (р. 1904), а впоследствии развита В. Гейзенбергом).
Протон (р)имеет положительный заряд, равный заряду электрона, и массу покоя тр = 1,6726·10 -27 кг ≈ 1836 me, где me – масса электрона. Нейтрон (n) нейтральная частица с массой покоя mn = 1,6749·10 -27 кг ≈ 1839 me. Протоны и нейтроны называются нуклонами (от лат. nucleus — ядро). Общее число нуклонов в атомном ядре называется массовым числом А.
Атомное ядро характеризуется зарядом Zе,где е — заряд протона, Z – зарядовое число ядра, равное числу протонов в ядре и совпадающее е порядковым номером химического элемента в Периодической системе элементов Менделеева. Известные в настоящее время 107 элементов таблицы Менделеева имеют зарядовые числа ядер от Z = 1 до Z = 107.
Ядро обозначается тем же символом, что и нейтральный атом: 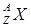 , где Х – символ химического элемента, Z – атомный номер (число протонов в ядре), А – массовое число (число нуклонов в ядре).
, где Х – символ химического элемента, Z – атомный номер (число протонов в ядре), А – массовое число (число нуклонов в ядре).
Так как атом нейтрален, то заряд ядра определяет и число электронов в атоме. От числа же электронов зависит их распределение по состояниям в атоме, от которого, в свою очередь, зависят химические свойства атома. Следовательно. заряд ядра определяет специфику данного химического элемента, т.е определяет число электронов в атоме, конфигурацию их электронных оболочек, величину и характер внутриатомного электрического поля.
Ядра с одинаковыми Z, но разными А (т. е. с разными числами нейтронов N = А – Z)называются изотопами, а ядра с одинаковыми А, но рамными Z изобарами. Например, водород (Z = 1) имеет три изотопа: 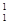 Н – протий (Z = 1, N = 0),
Н – протий (Z = 1, N = 0), 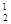 H – дейтерий (Z = 1, N = 1),
H – дейтерий (Z = 1, N = 1), 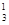 H – тритий (Z = 1, N = 2), олово – 10, и т. д. В подавляющем большинстве случаев изотопы одного и того же химического элемента обладают одинаковыми химическими и почти одинаковыми физическими свойствами (исключение составляют, например, изотопы водород), определяющимися в основном структурой электронных оболочек, которая является одинаковой для всех изотопов данного элемента. Примером ядер-изобар могут служить ядра
H – тритий (Z = 1, N = 2), олово – 10, и т. д. В подавляющем большинстве случаев изотопы одного и того же химического элемента обладают одинаковыми химическими и почти одинаковыми физическими свойствами (исключение составляют, например, изотопы водород), определяющимися в основном структурой электронных оболочек, которая является одинаковой для всех изотопов данного элемента. Примером ядер-изобар могут служить ядра 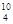 Ве,
Ве, 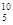 В,
В, 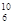 С. В настоящее время известно более 2000 ядер, отличающихся либо Z, либо А, либо тем и другим.
С. В настоящее время известно более 2000 ядер, отличающихся либо Z, либо А, либо тем и другим.
 2014-02-02
2014-02-02 801
801








