Углеводороды
Лекция № 6
· Химические свойства алканов. Реакции свободнорадикального замещения (галогенирование, нитрование, сульфохлорирование и сульфоокисление). Понятие о цепных реакциях (стадии, квантовый выход). Селективность свободнорадикальных реакций и относительная стабильность свободных радикалов. Термические превращения алканов: изомеризация, крекинг. Окисление алканов. Применение алканов в органическом синтезе и в качестве моторного топлива. Детонационные и антидетонационные свойства топлива.
Старое название алканов - парафины. Этот термин происходит от латинского parum affinis (малое сродство) и говорит о низкой реакционной способности этого класса углеводородов. В обычных условиях на алканы не действуют концентрированные кислоты и щелочи, они инертны по отношению к сильным окислителям и восстановителям.
Как было отмечено ранее, в алканах все атомы углерода связаны с четыремя другими атомами. Отсутствие в молекулах этого класса веществ кратных связей не позволяет рассчитывать на возможность протекания реакций присоединения.
Для соединений этого класса характерны реакции замещения. Характерным примером такого типа реакций являются хлорирование и бромирование алканов.
Рассмотрим хлорирование метана. Реакция протекает при нагревании или облучении смеси ультрафиолетовым светом. При этом атом хлора замещает атом водорода в метане, а второй атом хлора связывает атом водорода.
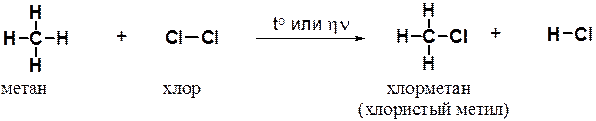
Образующийся в ходе реакции хлорметан в свою очередь вступает в реакцию с хлором с образованием дихлорметана (хлористого метилена). Далее реакция может продолжаться с образованием CHCl3 (хлороформа) и, в конце концов, -четыреххлористого углерода (CCl4).

В реакции может образоваться четыре продукта. Можно ли процесс остановить на требуемой стадии?
Реакция непосредственного галогенирования используется только для получения моно- или пер-галогеноалканов. Для проведения однозначной реакции используют большой избыток одного из реагентов. Для проведения реакции монохлорирования используют большой избыток метана. Основным продуктом реакции будет хлористый метил. Большое различие в температурах кипения между метаном и хлорметаном (> 130о С) позволяет легко отделить непрореагировавший метан и использовать его повторно. Аналогично проводят реакцию получения тетрахлорметана, используя большой избыток молекулярного хлора. В этом процессе разделение продукта и непрореагировавшего реагента еще проще, т.к. при комнатной температуре хлор находится в газообразном состоянии, а четыреххлористый углерод – жидкость.
Бром взаимодействует с метаном при высокой температуре или освещении ультрафиолетовым светом с образованием соответствующих производных (от моно- до тетрабромметана).

Реакция метана с йодом не идет, а с фтором протекает со взрывом даже в темноте и при комнатной температуре. Обычно для получения насыщенных фтор- и йодпроизводных используют другие методы синтеза.
Таким образом, реакционная способность галогенов в реакции с метаном изменяется в следующем порядке: F2 > Cl2 > Br2 (> I2)
В реакциях галогенов с другими алканами порядок изменения их реакционной способности не меняется.
Термин «реакционная способность» очень распространен в органической химии. Как правило, при сравнении реакционной способности сравнивают скорость или легкость протекания реакции. Если утверждается, что хлор по отношению к метану, более реакционноспособен, чем бром, это означает, что в идентичных условиях хлорирование метана происходит быстрее, чем бромирование. Чтобы реакция с бромом протекала с такой же скоростью, как с хлором, ее надо проводить в более жестких условиях (при более высокой температуре или при больших концентрациях).
 2014-02-02
2014-02-02 3113
3113








