нерастворимое вещество; прочерк означает, что вещество не существует или разлагается водой)
| Катионы | ||||||||||||||||||||||||||||
| Анионы | Li+ K+, Na+ NH4+ Cu2+ Ag+ Mg2+ Ca2+ Sr2+ Ba2+ Zn2+ Hg2+ Al3+ Sn2+ Pb2+ Bi3+ Cr3+ Mn2+ Fe3+ Fe2+ | |||||||||||||||||||||||||||
| Cl- | Р | Р | Р | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Р | Р | Р | Р | |||||||||
| Br- | Р | Р | Р | Р | Н | Р | Р | Р | Р | Р | М | Р | Р | М | - | Р | Р | Р | Р | |||||||||
| I- | Р | Р | Р | - | Н | Р | Р | Р | Р | Р | Н | Р | Р | Н | - | Р | Р | - | Р | |||||||||
| NO3- | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | Р | - | Р | Р | |||||||||
| CH3COO- | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | - | - | Р | - | Р | |||||||||
| S2- | Р | Р | Р | Н | Н | - | Р | Р | Р | Н | Н | - | Н | Н | Н | - | Н | Н | Н | |||||||||
| SO32- | Р | Р | Р | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | - | Н | - | Н | |||||||||
| SO42- | Р | Р | Р | Р | М | Р | М | Н | Н | Р | - | Р | Р | Н | - | Р | Р | Р | Р | |||||||||
| CO32- | Р | Р | Р | - | Н | Н | Н | Н | Н | Н | - | - | - | Н | Н | - | Н | - | Н | |||||||||
| CrO42- | Р | Р | Р | Н | Н | Р | М | М | Н | Н | Н | - | - | Н | Н | Р | Н | - | - | |||||||||
| PO43- | Н | Р | Р | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | |||||||||
| OH- | Р | Р | Р | Н | - | Н | М | М | Р | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | |||||||||
Таблица 6.3
Константы и степени диссоциации
некоторых слабых электролитов
| Электролиты | Формула | Числовые значения констант диссоциации | Степень диссоциации в 0,1Н растворе, в %. |
| Азотистая кислота | HNO2 | K = 4,0.10-4 | 6,4 |
| Аммиак (гидроксид) | NH4OH | К = 1,8.10-5 | 1,3 |
| Муравьиная кислота | HCOOH | К = 1,76.10-4 | 4,2 |
| К1 = 5,8.10-10 | 0,007 | ||
| Ортоборная кислота | H3BO3 | К2 = 1,8.10-13 | |
| К3 = 1,6.10-14 | |||
| Ортофосфорная | К1 = 7,7.10-3 | ||
| кислота | H3PO4 | К2 = 6,2.10-8 | |
| К3 = 1,3.10-12 | |||
| Сернистая кислота | H2S03 | К1 = 1,7.10-2 | |
| К2 = 6,2.10-8 | |||
| Сероводородная | H2S | К1 = 5,7.10-8 | 0, 07 |
| кислота | К2 = 1,2.10-15 | ||
| Синильная кислота | HCN | К = 7,2.10-10 | 0,009 |
| Угольная кислота | H2CO3 | К1 = 4,3.10-7 | 0,17 |
| К2 = 5,6.10-11 | |||
| Уксусная кислота | CH3COOH | К = 1,75.10-5 | 1,3 |
| Фтороводородная кислота | HF | К = 7,2.10-4 | 8,5 |
а) отношение последовательных констант диссоциации многоосновных кислот 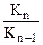 составляет 10
составляет 10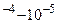 . Например, для фосфорной
. Например, для фосфорной
кислоты: 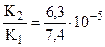 и
и 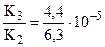 .
.
б) сила кислоты увеличивается с ростом (m - n) в формуле кислоты, что объясняется оттягиванием электронной плотности на атомы кислорода, несвязанные с атомами водорода, что увеличивает полярность связи Н - О -.
Например, в HClO4, HNO3, H3PO4 и H3BO3 величина (m - n) равна 3, 2, 1 и 0, соответственно, поэтому сила кислот в этом ряду резко уменьшается (K1 от 1010 в HClO4 до примерно 10-10 в H3BO3);
в) при одинаковых формулах кислот их сила уменьшается с увеличением радиуса центрального атома Х. Например, H3AsO3 - слабая кислота, H3SbO3 - амфотерное соединение, H3BiO3 – почти не проявляет кислотных свойств, и лучше говорить, что Bi(OH)3 - слабое основание.
Естественно, что эти формальные правила имеют многие исключения. Например, при сравнении силы кислот и оснований этим способом необходимо, чтобы они имели одинаковые структурные формулы. Так, пирофосфорная кислота H4P2O7 имеет 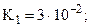
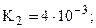
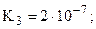
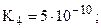 только переход от K2 к K3 подчиняется правилу 4а. Это связано с тем, что в молекуле имеется два эквивалентных атома фосфора и, соответственно, две пары эквивалентных атомов водорода, что и приводит к нарушению формального правила (хотя, по существу, между двумя парами атомов все же приблизительно выполняется правило 4а: K3/K1» 10-5 и K4/K2» 10-7)
только переход от K2 к K3 подчиняется правилу 4а. Это связано с тем, что в молекуле имеется два эквивалентных атома фосфора и, соответственно, две пары эквивалентных атомов водорода, что и приводит к нарушению формального правила (хотя, по существу, между двумя парами атомов все же приблизительно выполняется правило 4а: K3/K1» 10-5 и K4/K2» 10-7)
ОН ОН
| |
Н - О - Р - О - Р - О - Н.
|| ||
О О
 2014-02-02
2014-02-02 687
687








