В многоэлектронном атоме
Заполнение атомных орбиталей электронами
 Распределение электронов в многоэлектронных атомах по энергетическим уровням и подуровням подчиняется следующим законам:
Распределение электронов в многоэлектронных атомах по энергетическим уровням и подуровням подчиняется следующим законам:
1. Принцип наименьшей энергии.
Каждой атомной орбитали отвечает определенная энергия. Порядок следования АО по энергии определяется двумя правилами Клечковского:
1) энергия электрона в основном определяется значениями главного (n) и орбитального (l) квантовых чисел, поэтому сначала электронами заполняются те подуровни, для которых сумма (n + l) меньше.
Например, можно было бы предположить, что 3d-подуровень по энергии ниже, чем 4s. Однако, согласно правилу Клечковского, энергия 4s-состояния меньше, чем 3d, так как для 4s сумма (n + l) = 4 + 0 = 4, а для 3d - (n + l) = 3 + 2 = 5.
2) В случае, если сумма (n + l) для двух подуровней одинакова (например, для 3d- и 4p-подуровней эта сумма равна 5), сначала заполняется электронами уровень с меньшим n. Поэтому формирование энергетических уровней атомов элементов четвертого периода происходит в такой последовательности: 4s - 3d - 4p. Например:
21Sc 1s22s22p63s23p64s23d1, 31Ga 1s22s22p63s23p64s23d104p1
Таким образом, с учетом правил Клечковского энергия атомных орбиталей возрастает согласно ряду
1s < 2s < 2p < 3 < 3p < 4s ≤ 3d < 4p < 5s ≤ 4d < 5p < 6s ≤ 4f ≤ 5d < 6p < 7s ≤ 5f ≤ 6d < 7p
Примечание. Знак ≤ означает, что энергии АО близки, так что здесь возможно нарушение правил Клечковского.
Пользуясь этим рядом, можно определить электронное строение любого атома. Для этого нужно последовательно добавлять и размещать на подуровнях и атомных орбиталях электроны. При этом необходимо учитывать принцип Паули и два правила Хунда.
3. Принцип Паули определяет емкость АО: в атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел.
Иными словами, на одной АО, характеризуемой тремя квантовыми числами, может разместиться только два электрона с противоположными спинами, т.е. для одной АО можно записать два возможных варианта её заполнения:
 |  |
одним электроном ↑ и двумя электронами ↓↑.
При этом конкретное направление спина для одного электрона на орбитали не имеет значения, важно лишь, что спины для двух электронов на одной АО имеют противоположные знаки. Принцип Паули и взаимозависимость между значениями n, l, и m определяют максимально возможное количество электронов на орбитали, подуровне и уровне (табл. 2.4):
- на одной АО - 2 электрона;
- на подуровне l - 2(2l+1) электрона;
- на уровне n - 2n2 электронов.
Таблица 2.4
Распределение электронов
по энергетическим уровням, подуровням и орбиталям
| Энергетический уровень | Главное квантовоечисло | Энергетический подуровень | Атомные орбитали | Максимальное число электронов | |
| подуровень | уровень | ||||
 1 1 | s (l = 0) | ||||
| s (l = 0) |  | ||||
   2 2 | p (l = 1) | ||||
 | s (l = 0) | ||||
   3 3 | p (l = 1) | ||||
     | d (l =2) |
4. Два правила Хунда описывают порядок заполнения электронами АО одного подуровня:
Первое правило: в данном подуровне электроны стремятся заполнять энергетические состояния (АО) таким образом, чтобы сумма их спинов по абсолютной величине была максимальна. При этом энергия системы минимальна.
Например, рассмотрим электронную конфигурацию атома углерода. Атомный номер этого элемента равен 6. Это означает, что в атоме 6 электронов и они расположены на 2-х энергетических уровнях (атом углерода находится во втором периоде), т.е. 1s22s22p2. Графически 2р-подуровень можно изобразить тремя способами:
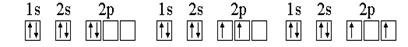
m 0 0 +1 0 -1 0 0 +1 0 -1 0 0 +1 0 -1
 2014-02-02
2014-02-02 3656
3656
