Чем меньше значение Кн, тем более прочен данный комплекс.
Сравним, например, константы нестойкости и устойчивость ряда комплексов серебра [Ag(NO2)2]-, [Ag(NH3)2]+, [Ag(S2O3)]3- и [Ag(CN)2]-. Для них Кн: 1,3·10-3 ; 5,7·10-8; 2,5·10-14 и 8,0·10-21, соответственно. Следовательно, можно прийти к выводу, что наименее устойчивым из этих ионов является первый, а наиболее устойчивым - последний. Очевидно также, что при одной и той же молярной концентрации комплексного соединения концентрация ионов Аg+ будет больше в растворе первого соединения и меньше в растворе последнего.
Для объяснения образования и свойств комплексных соединений в настоящее время применяется теория валентных связей (ВС), теория кристаллического поля (ТКП) и теория молекулярных орбиталей (МО). Мы ограничимся методом ВС.
Теория ВС для комплексных соединений. Пространственная структура комплексных частиц может быть объяснена с позиций метода (ВС). Согласно этому методу связь между центральным атомом и лигандами образуется за счет донорно-акцепторного взаимодействия: лиганд - донор, а центральный атом - акцептор электронной пары. При этом ковалентная s-связь образуется в результате перекрывания вакантной орбитали центрального атома или иона комплексообразователя с заполненными, т.е. содержащими неподеленные пары электронов, орбиталями лигандов. Максимально возможное число s-связей определяет координационное число комплексообразователя. Поскольку при одинаковых лигандах образующиеся s-связи равноценны, то образование комплексной частицы сопровождается гибридизацией акцепторных орбиталей комплексообразователя. Критерием для определения типа гибридизации могут служить опытные данные о магнитных свойствах образующихся комплексов.
Пример 9. Определить пространственную структуру и устойчивость комплексных ионов: а) парамагнитного [CoF6]3- и б) диамагнитного [Co(NH3)6]3+.
Решение. а) [CoF6]3- - координационное число Co равно 6, степень окисления (w) Co = +3; электронное строение атома Co -…3d74s2, иона Co3+ -....3d64s04p04d0; для F -..2s22p5, для иона F- -.. 2s22p6.
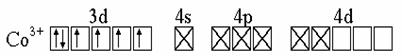
(Крестомобозначена неподеленная пара электронов от лиганда - иона F-).
Из показанной схемы ВС следуют выводы:
1. Co3+ - акцептор 6-ти электронных пар;
2. АО Co3+ гибридизованы, тип гибридизации sp3d2 – октаэдричес-
кий;
3. комплекс имеет 4 неспаренных электрона, он парамагнитен;
4. комплекс внешнеорбитальный, т.к. в образовании донорно-акцепторных связей принимают участие внешние 4d-АО (3d-АО - внутренние орбитали). Использование внешних d-орбиталей требует затраты энергии, поэтому комплекс неустойчив.
б) [Co(NH3)6]3+ - координационное число Co равно 6, степень окисления
(w)Сo = +3. Электронное строение NH3 таково, что каждая молекула имеет неподеленную электронную пару,за счет которой эта молекула будет донором. Так как комплекс диамагнитен, то все шесть d-электронов спарены, поэтому схему ВС для этого комплекса можно изобразить так:

Из этой диаграммы следуют выводы:
1. Co3+ - акцептор 6-ти электронных пар;
2. АО (Co3+) гибридизованы по типу d2sp3 - они образуют октаэдр;
3. комплекс диамагнитен, все электроны спарены;
4. комплекс внутриорбитальный, так как акцепторами являются внутренние 3d-атомные орбитали, он устойчивее, чем внешнеорбитальный.
Из приведенных примеров видны следующие особенности применения теории ВС к комплексам:
1. Для построения схемы ВС используются атомы и ионы с зарядом, соответствующим степени окисления.
2. Для образования химической связи не используются электроны центрального атома; используются лишь его пустые АО и электронные пары лигандов. (Однако возможен дополнительный учет дативного взаимодействия между парами d-электронов металла и пустыми (акцепторными) орбиталями лигандов).
3. Вопрос о расположении электронов на d-АО (и вопрос о магнитных свойствах) в теории ВС не решается, используются экспериментальные данные или данные других теорий (например, теория кристаллического поля - ТКП).
4. В методе ВС вопросы геометрии комплекса, гибридизации АО, устойчивости решаются по схемам ВС.
 2014-02-02
2014-02-02 4941
4941