Давно было замечено, что простейшие соединения водорода с легкими электроотрицательными элементами, например фтором или кислородом, отличаются от аналогичных соединений с тяжелыми элементами аномально высокими температурами кипения и плавления. На рисунке 3.28 приведены кривые зависимости температур кипения простых водородных соединений р-элементов V-VII групп от номера периода.
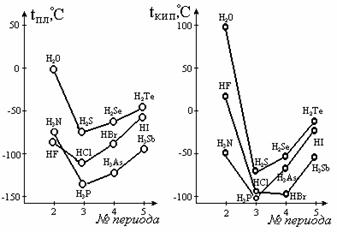
Рис. 4.28. Зависимость температуры плавления (а) и кипения (б)
водородных соединений р-элементов V, VI и VII групп от № периода
Видно, что для них наблюдается последовательное повышение температуры кипения с ростом номера периода, но из нее заметно выпадают вода, фтороводород и аммиак. Экстраполяция температуры на графике дает tкип воды около -80оС. То же происходит с теплотой плавления и испарения. Объяснение этим и другим фактам было дано русскими химиками Ильинским и Бекетовым в 80-х годах XIX века. Они предположили, что между молекулами таких соединений существует особая, водородная, связь. Ее образование объясняется особыми свойствами атома водорода: катион Н+, в отличие от других катионов, является элементарной частицей с резко отличающимися размерами (меньше обычных атомов в 105 раз) и высокой подвижностью.
Поэтому он может осуществлять связь между соседними атомами, если они несут на себе отрицательные заряды. Характер связи при этом близок к ионному. А так как Rэ->> Rн+ , то угол связи ЭНЭ равен 1800.
, то угол связи ЭНЭ равен 1800.
+d -d +d -d +d -d
H ¾ F¼¼H ¾ F¼¼H ¾ F
Благодаря водородным связям молекулы объединяются в димеры и более сложные ассоциаты. Последние могут иметь линейное, разветвленное или кольцевое строение. Ассоциация приводит к повышению температуры кипения, температуры плавления и теплоты парообразования, изменению растворяющей способности и т.д. Энергия водородной связи меньше, чем обычных ковалентных и ионных связей (обычно менее 40 кДж/моль). Она тем больше, чем больше электроотрицательность элемента, Так, энергия водородной связи Н...F составляет около 40, связи Н....О - 20, Н...N - 8 кДж/моль. Обозначается такая связь обычно пунктиром.
Все рассмотренные примеры относятся к межмолекулярным водородным связям. Нередко водородные связи объединяют части одной и той же молекулы, то есть являются внутримолекулярными. Это характерно для многих органических веществ.
Следует отметить, что внутримолекулярные водородные связи, в отличие от рассмотренных межмолекулярных, понижают температуры и теплоты кипения и плавления веществ. Так, например, орто-нитрофенол, имеющий внутримолекулярную водородную связь, плавится при 450С, а мета-нитрофенол, молекулы которого ассоциированы за счет межмолекулярной водородной связи, - при 970С.
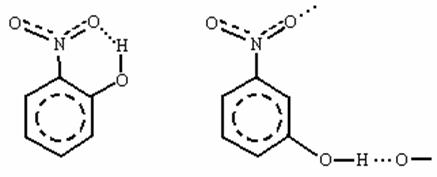
орто-нитрофенол мета-нитрофенол
Водородные связи имеют большое значение в живой и неживой природе. Например, построение белковых молекул, особые свойства воды, формируемые с участием водородных связей, обеспечивают само существование жизни на Земле.
 2014-02-02
2014-02-02 1419
1419
