Додецилсульфат натрия (ДДС-Na) Цетилтриметиламмонийбромид (ЦТАБ)
Гомогенизацию объектов рассматривают как начальную стадию выделения белков, но способ ее определяется конкретной задачей. Например, выделение ферментов из растительных материалов затруднено из-за экстрагирования большого количества фенолов, которые взаимодействуя с карбонильными группами пептидных групп при помощи водородных связей, вызывают денатурацию белка и потерю ферментами активности. Добавление в экстракт поливинилпирролидона, которые образуют с фенолами нерастворимые комплексы, предотвращает инактивацию ферментов.
Для изучения свойств белков обязательным условием является получение их в индивидуальном и, по возможности, не денатурированном состоянии.
Методы выделения, очистки и фракционирования белков
Липопротеиды высокой плотности (ЛПВП),
Липопротеиды низкой плотности (ЛПНП)
Хиломикроны,
Фосфопротеиды присутствуют и в костной и нервной тканях.
Липопротеиды. Сложные белки, простетическая группа которых образована липидами. Они представляют собой небольшого размера (150-200 нм) сферические частицы, наружная оболочка которых образована белками, придающими им гидрофильные свойства и способность передвигаться по крови, внутренняя часть – липидами и их производными.
Основная функция липопротеидов – транспорт по крови липидов. Липопротеиды подразделяются на:
Хиломикроны- наиболее крупные из липопротеидов, содержат до 98-99% липидов и 1-2% белка. Образуются в слизистой оболочке кишечника обеспечивают транспорт липидов в лимфу и кровь.
В ЛПНП количество белка составляет 9-20%, в них преобладают холестерин и триацилглицерины (до 40%). Холестерин транспортируется по крови больше в составе этой фракции.
В ЛПВП белковая часть составляет 35-50%, небелковая – фосфолипиды, холестерин.
Белки обычно теряют природные (нативные) свойства (растворимость, гидратация, ферментативная активность и т.д.), подвергаясь денатурации под влиянием различных факторов. Типичным примером необратимой денатурации белков является выпадение их в осадок под действием трихлоруксусной кислоты (ТХУ). Длительный контакт со спиртом также приводит к необратимой денатурации белка. Денатурирующее действие различных факторов на белки можно смягчить проведением операций при температуре не выше +4 °С.
Методы выделения и очистки белков. Схема выделения белков сводится к измельчению биологического материала (гомогенизация), экстрагированию и собственно выделению, то есть очистке и получению белка в индивидуальном состоянии.
Разрушение клеточной структуры проводят измельчением материала в гомогенизаторах, мельницах, попеременным замораживанием и оттаиванием, применением ультразвуковых высокочастотных колебаний, пресс-методов с использованием высоких давлений и метода "азотной бомбы". В последнем случае клетки насыщаются азотом под давлением, которое затем сбрасывается, и клетки разрушаются.
На эффективность гомогенизации влияет не только способ разрушения клеточных структур, но и вид исследуемого материала. Так, животные клетки разрушаются относительно быстро, особенно в отсутствие сосудистой и соединительной ткани, тогда как растительные и микробные из-за присутствия клеточных стенок – трудно. В таком случае применяют методы растирания материала с песком, абразивным порошком или обрабатывают его лизоцимом или ферментными препаратами, содержащими ферменты целлюлазу, хитиназу и липазу. Гомогенизацию рекомендуется проводить в холодных комнатах или с использованием льда.
Экстракция белков может быть совмещена с гомогенизацией клеток и тканей, либо проведена отдельно, если продукт заранее измельчен. Для определения ферментативной активности белка достаточно, например, одноразовой экстракции, тогда как для количественного определения белковых фракций зерна – трех- или пятикратной. Условия экстрагирования белков (время, гидромодуль, температура и т.д.) подбираются эмпирически, основываясь на методиках ведущих научных школ или индивидуальном опыте.
Большинство белков животных тканей хорошо растворяются в 5 – 10 % растворах солей, тогда как для белков зерновых культур применяют буферные системы со значениями рН от кислых до слабощелочных (фосфатные, боратные, цитратные, трис-HCl), органические растворители и детергенты, разрывающие белок-липидные или белок-белковые связи:
СН3
СН3 – (СН2)7 – (С6Н4) – О – СН2 – СНОН)10Н ï
Тритон Х-100 С16Н35 – N+ – CH3
ï
СН3 – (СН2)10 – СН2 – О – SО3Na CH3
Растворители подбираются с учетом разрыва в белках определенных типов связей. Так, уксусная кислота ослабляет ионные связи, сообщая молекулам одноименные положительные заряды, мочевина – водородные и гидрофобные, салицилат натрия и ДДС-Na – гидрофобные и ионные, а водные растворы спиртов – водородные и гидрофобные взаимодействия. Органические растворители разрывают белок-липидные связи.
Методы фракционирования и очистки от небелковых соединений основаны на различиях в растворимости, заряде, размерах молекул, сродстве к специфическим химическим группам.
Осаждение. Осаждение белков из раствора под действием солей щелочных и щелочноземельных металлов называют высаливанием. Процесс основан на понижении растворимости белка, которая зависит от их способности к гидратации. У глобулярных белков высокий уровень гидратации обеспечивается расположением на их поверхности гидрофильных групп. Осадители разрушают гидратную оболочку и вызывают осаждение белка. При повышенной концентрации соли или органических растворителей (спирт, ацетон) в растворе происходит сближение ионных атмосфер, образуемых противоионами белка, что способствует сближению их до расстояния, на котором межмолекулярные силы ван-дер-ваальсова притяжения перевешивают кулоновские силы отталкивания. Это приводит к слипанию белковых частиц и выпадению их в осадок.
Для высаливания часто применяется сульфат аммония, с которым белки, как правило, сохраняют растворимость и ферментативную активность, однако главную роль при этом играет не природа солей, а валентность ионов, действие которых оценивается по ионной силе (m):
m = ½ S С´V2,
где С – концентрация каждого вида иона; V – валентность ионов
Глобулины выпадают в осадок при 50 % насыщении, альбумины – при 100 % насыщения растворов солей, а при ступенчатом фракционировании от 20 до 100% насыщения могут выпадать белки и других классов (проламины, глютелины).
Изоэлектрическое осаждение. Заряд белков обусловлен в первую очередь остатками аспарагиновой, глутаминовой кислот (отрицательный заряд) и остатками лизина и аргинина (положительный заряд). По мере повышения рН заряд белков изменяется от положительных к отрицательным значениям и в изоэлектрической точке оказывается равен нулю. В результате белок лишается своей ионной атмосферы, частицы слипаются и выпадают в осадок.
Центрифугирование. Для отделенияосадка белка от раствора используется центрифугирование. Частицы осажденного вещества под действием центробежной силы оседают на дне центрифужных стаканов, формируются в плотный осадок, с которого легко сливается оставшийся раствор (надосадочная жидкость, или супернатант). Скоростные центрифуги (ультрацентрифуги) создают центробежное ускорение порядка 105g (т.е. 105 ускорений свободного падения), что позволяет осаждать даже некоторые крупные надмолекулярные агрегаты - рибосомы и вирусы.
В методе ультрафильтрации белки в градиенте плотности распределяются на разных уровнях центрифужной пробирки в процессе седиментации (осаждение) в виде отдельных зон. Для создания градиента используют соли тяжелых металлов и растворы сахарозы. Метод широко применяется для определения молекулярных масс белков по константе седиментации (S), которая зависит от массы и формы белковых частиц:
v
 v, w2´r
v, w2´r
где v – скорость перемещения границы растворитель-белок, см/с; w – угловая скорость ротора, рад/с; r – расстояние от центра ротора до середины ячейки с раствором белка.
Величина S, равная 1´10-13 c, принята за единицу и названа сведбергом (S) в честь Т. Сведберга, который впервые разработал ультрацентрифугу.
При диализе используют полупроницаемые мембраны (целлофан из нитрата целлюлозы, коллодийная пленка), через которые белки не

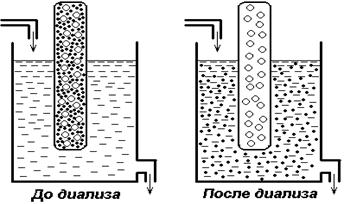 |
диффундируют и остаются внутри диализного мешочка. Более мелкие молекулы проходят через поры диализной мембраны и выходят в диализат в сосуд с водой. Непрерывный ток воды через сосуд приводит к полному переходу в него всех проходящих через целлофан веществ, а белки остаются внутри диализного мешочка
В методе ультрафильтрации, который применяется в производстве сывороточных белков молока, соевых белковых изолятов, по обе стороны мембраны создается разность давлений за счет продавливания фильтруемого белкового раствора. В качестве мембран используются целлюлозные пленки и нецеллюлозные полиэлектролитные комплексы. Аналогично мембранам по принципу молекулярного сита действуют и полые волокна. Белковый раствор помещается с внешней стороны волокон и создается разность давления за счет повышения его в растворе или понижения внутри их.
Адсорбционная хроматография основана на различиях на различном сродстве (полярности) компонентов смесей к определенным веществам - сорбентам. В колонке вместе с буферным раствором упаковывают адсорбент (гель фосфата кальция, оксид алюминия, активированный уголь, силикагель, пористое стекло) или используют, например, готовые алюминиевые пластины (тонкослойная хроматография – ТСХ) с нанесенным уже адсорбентом, на которые наносят в небольшом объеме растворителя исследуемый образец. Компоненты смеси адсорбируются на адсорбенте, затем элюируются с помощью буферного раствора с увеличивающейся концентрацией или полярностью. Фракции белка собираются с помощью автоматического коллектора фракций или количественно исследуются на приборе денситометр (ТСХ).
В распределительной хроматографии, в отличие от адсорбционной, в качестве неподвижной фазы выступает водный слой, удерживаемый твердой фазой (силикагель, бумага). Разделяемые вещества многократно распределяются между водным слоем и движущейся фазой растворителя и с разной скоростью перемещаются по длине колонки или бумаге. Для анализа пептидов и аминокислот чаще используют хроматографию на бумаге. Адсорбентом служат нити целлюлозы, а растворителем – смесь органических растворителей (бутиловый спирт–уксусная кислота–вода). Хроматограмму проявляют, высушивают и анализируют местонахождение разделяемых компонентов.
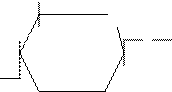
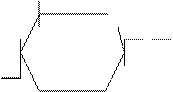
Метод ионообменной хроматографии белков или аминокислот основан на разделении на основе различий в заряде молекул. Если белок в нейтральной среде (рН 7) имеет положительный заряд, то он связывается на колонке с ионообменником, содержащим фенольные, сульфо- и карбоксильные группы (катионообменник), если отрицательный, то – на колонке с ионообменником, представленным аминами или органическими основаниями (анионообменник). Чаще всего для фракционирования белков используют производные полистирола и целлюлозы:
|
|
|
|
|
|
|
|
Диэтиламиноэтилцеллюлоза Карбоксиметилцеллюлоза
(ДЭАЭ – целлюлоза) (КМЦ)
Положительно заряженный белок снимается с колонки с помощью раствора хлористого натрия или изменением рН элюирующего буфера. При этом ионы натрия конкурируют с положительно заряженными группами белков. Белки с меньшим положительным зарядом вымываются с колонки первыми, с большим зарядом – последними.
Гель-фильтрация или метод молекулярных сит заключается в пропускании белков через колонку с гелем сефадекса или другими типами (агарозные, полистирольные). Применяются также пористые стеклянные шарики и пористый кварц (порасил). Наибольшее распространение получили декстрановые гели (сефадекс), являющиеся продуктом поперечного сшивания полисахаридных цепочек декстрана. Зерна сефадексов разных номеров содержат поры разных размеров, в которые могут проникать белки с определенной молекулярной массой. Низкомолекулярные белки распределяются в растворенном виде как внутри частиц полимера, так и между ними, а высокомолекулярные – только между частицами, поэтому вторые быстрее проходят через колонку и первыми вытекают из нее.
 2014-02-03
2014-02-03 5535
5535
