В сутки с пищей поступает около 100 г белков.
Переваривание белков осуществляется протеолитическими ферментами желудочного, поджелудочногои кишечного соков.
Расщепление пищевых белков начинается в полости желудка под воздействием желудочного сока. Вырабатывается желудочный сок железами стенки желудка, причем его компоненты образуются разными клетками. Так, главные клетки синтезируют пепсиноген – белок, являющийся предшественником фермента пепсина (т.е. проферментом);обкладочные клетки осуществляют выработку соляной кислоты, а добавочные клетки выделяют в полость желудка белок муцин, который в форме вязкой слизи покрывает стенку желудка и защищает ее от соляной кислоты и пепсина.
Попадая в полость желудка, пепсиноген под влиянием соляной кислоты превращается в активный протеолитический фермент пепсин. При этом от пепсиногена отщепляется небольшой полипептид, экранирующий (закрывающий) активный центр. Образовавшийся пепсин подобно соляной кислоте вызывает быстрое превращение остальных порций пепсиногена в активную форму. Такой механизм активации пепсина называется аутокатализом. Образование активного пепсина в полости желудка, т.е. во внешней среде, предупреждает нежелательное воздействие этого фермента на белки клеток желудка, где происходит его образование. Муцин, покрывающий защитным слоем поверхность пищеварительного тракта, к действию пепсина устойчив.
Под воздействием образовавшегося пепсина в пищевых белках расщепляются пептидные связи, находящиеся в глубине их молекул. В результате такого действия пепсина белковые молекулы превращаются в смесь полипептидов различной длины, которую иногда называют пептоном. Тепловая обработка пищи, вызывающая денатурацию белков, облегчает переваривание белков пищи, так как денатурация вызывает изменение пространственной формы белковой молекулы, и внутренние пептидные связи становятся доступными для пепсина и других протеолитических ферментов.
Соляная кислота, входящая в состав желудочного сока, кроме активации пепсина, еще создает в полости желудка оптимальную для действия пепсина сильнокислую среду (рН 1-2). Соляная кислота также вызывает денатурацию пищевых белков, что способствует лучшему их расщеплению пепсином. Кроме этого соляная кислота, являясь сильной кислотой, обладает бактерицидным действие и обезвреживает микробы, поступающие с пищей в желудок.
Дальнейшее переваривание белков протекает в тонкой кишке, куда из желудка поступает смесь полипептидов различной длины. В составе поджелудочного сока, поступающего в тонкую кишку, содержатся проферменты - трипсиноген, химотрипсиноге и проэластаза, которые синтезируются в поджелудочной железе.
Превращение проферментов в активную форму происходит в тонкой кишке. Вначале под действием фермента энтерокиназы, встроенного в мембрану клеток тонкой кишки, трипсиноген становится трипсином. Далее образовавшийся трипсин активирует переход остальных проферментов - химотрипсиногена и проэластазы соответственно в химотрипсин и эластазу, причем трипсин путем аутокатализа также стимулирует превращение бóльшей части трипсиногена в трипсин.
Образовавшиеся трипсин и химотрипсин расщепляют полипептиды, поступившие в тонкую кишку из желудка, до олигопептидов, состоящих из нескольких аминокислот, преимущественно ди- и трипептидов.
Эластаза предназначена для расщепления прочных белков соединительной ткани – коллагена и эластина. Под ее действием эти белки тоже превращаются в олигопептиды.
Завершается переваривание белков в тонкой кишке под действием ферментов кишечного сока. Эти ферменты встроены в стенку микроворсинок и не выделяются в полость кишки. Поэтому расщепление ранее образовавшихся олигопептидов происходит на поверхности микроворсинок и называется пристеночным или мембранным пищеварением. Аминокислоты, возникающие на поверхности микроворсинок сразу же всасываются, и по системе воротной вены поступают в печень и далее в большой круг кровообращения. Незначительная часть аминокислот всасывается в лимфатическую систему. Всасывание аминокислот, сопровождающееся переносом их через мембраны, требует энергии АТФ.
Катаболизм белков.
Белки, входящие в составклеток организма, также подвергаются постоянному распаду под влиянием внутриклеточных протеолитических ферментов, называемых внутриклеточными протеиназами или катепсинами. Эти ферменты локализованы в специальных внутриклеточных органоидах - лизосомах. Мембраны, окружающие лизосомы, непроницаемы для катепсинов, но зато пропускают во внутрь лизосом белки, подлежащие протеолизу. По своему действию катепсины похожи на ферменты желудочного и поджелудочного соков: катепсины вызывают превращение белков в олигопептиды, которые легко выходят из лизосом в цитоплазму клеток и превращаются там в аминокислоты. Такой распад протекает с участием цитоплазматических ферментов, аналогичных ферментам кишечного сока.
В последние годы в цитоплазме клеток организма обнаружены особые белковые мультиферментные комплексы, названные протеасомами. Протеасомы предназначены для избирательного расщепления белков, которых не должно быть в клетках. Такому превращению подвергаются чужеродные и дефектные белки, а также регуляторные белки, присутствие которых ограничено во времени (например, белки – гормоны, белки – регуляторы транскрипции).
Для предупреждения чрезмерного распада собственных белков в организме имеются особые белки – эндогенные ингибиторы протеиназ, снижающие скорость протеолиза. Особенно много таких ингибиторов протеолиза в богатой белками плазме крови.
В сутки внутриклеточному протеолизу подвергается 200-300 г собственных белков организма, что приводит к возникновению примерно такого же количества аминокислот.
Важно отметить, что при распаде как пищевых, так и собственных белков организма образуются аминокислоты одних и тех же 20 видов.Поэтому в течение суток в организме появляется около 300-400 г свободных аминокислот.
Глубокий распад белков, сопровождающийся расщеплением всех пептидных связей и приводящий к образованию аминокислот, называется тотальным протеолизом.
В некоторых случаях под действием протеолитических ферментов в молекуле белка избирательно расщепляется лишь одна пептидная связь между строго определенными аминокислотами и от белка отщепляется часть его молекулы – полипептид. Такой распад белков получил название ограниченный протеолиз. Примером ограниченного протеолиза является превращение проферментов в ферменты (например, активация протеолитических ферментов, участвующих в пищеварении; переход факторов свертывания крови из неактивной формы в активную).
9.3.Синтез белков
Бόльшая часть аминокислот используется для синтеза белков. В организме взрослого человека существует равновесие между распадом и синтезом белков. У детей преобладает синтез, ведущий к накоплению белков в организме, что является обязательным условием роста и развития организма.
Синтез белков происходит при обязательном участии нуклеиновых кислот.
Первый этап синтеза белка - транскрипция осуществляется в клеточном ядре с использованием ДНК как источника генетической информации. Генетическая (наследственная) информация обусловливает порядок расположения аминокислот в полипептидных цепях синтезируемого белка. Эта информация закодирована строгой последовательностью азотистых оснований в молекуле ДНК. Каждая аминокислота кодируется сочетанием трех азотистых оснований, называемым кодоном или триплетом. Участок молекулы ДНК, содержащий информацию об определенном белке, получил название ген. На этом участке ДНК во время транскрипции по принципу комплементарности синтезируется информационная РНК ( иРНК ), Эта нуклеиновая кислота представляет собой копию соответствуюшего гена. Следовательно, иРНК содержит информацию о строении белка, закодированного в данном гене. Образовавшаяся иРНК выходит из ядра и поступает в рибосомы.
Аналогичным образом на ДНК как на матрице происходит синтез рибосомных (рРНК) и транспортных ( ТРНК) РНК.
В ходе второго этапа – рекогниции (распознования), протекающего в цитоплазме, аминокислоты избирательно связываются со своими переносчиками - транспортными РНК ( ТРНК ).
Все тРНК (их обнаружено около 60) построены сходным образом. Молекула каждой тРНК представляет собой короткую полинуклетидную цепь, содержащую примерно 80 нуклеотидов и частично закрученную в двойную спираль, что приводит к возникновению пространственной конфигурации «изогнутого клеверного листа» (рис.1).
На одном конце полинуклеотидной цепи у всех тРНК находится нуклеотид, содержащий аденин. К этому концу молекулы тРНК присоединяется аминокислота. Петля, противоположная месту присоединения аминокислоты, содержит антикодон, состоящий из трех азотистых оснований и предназначенный для последующего связывания с комплементарным кодоном иРНК. Одна из из боковых петель молекулы тРНК. обеспечивает присоединение тРНК к ферменту, участвующему в рекогниции, а другая боковая петля необходима для присоединения тРНК рибосоме на следующем этапе синтеза белка.
На этом этапе в качестве источника энергии используется молекула АТФ. В результате рекогниции образуется комплекс аминокислота-тРНК (аминоацил-ТРНК):
 АМИНОКИСЛОТА + тРНКАМИНОАЦИЛ-тРНК
АМИНОКИСЛОТА + тРНКАМИНОАЦИЛ-тРНК

Рис. 1 Схема строения аминоацил-тРНК
В составе этого комплекса аминокислота обладает повышенной химической активностью. В связи с этим второй этап синтеза белка часто называют активацией аминокислот.
Третий этап синтеза белка- трансляция происходит на рибосомах. Каждая рибосома состоит из двух частей – большой и малой субчастиц. По химическому составу обе субчастицы представляют собою нуклеопротеиды, состоящие из рибосомных РНК и белков. Рибосомы способны легко распадаться на субчастицы (диссоциация), которые снова могут соединяться друг с другом, образуя рибосому (ассоциация).
Трансляция начинается с диссоциации рибосомы на субчастицы, которые сразу же присоединяются к начальной части молекулы информационной РНК, поступающей из ядра. При этом между субчастицами остается пространство (так называемый «туннель»), гдерасполагается небольшой участок иРНК.
Затем к образовавшемуся комплексу рибосома-иРНК присоединяются тРНК, связанные с аминокислотами. Присоединение тРНК к этому комплексу происходит путем связывания одной из боковых петлей тРНК с рибосомой и связывания антикодона тРНК с комлементарным ему кодоном иРНК, находящимся в туннеле между субчастицами рибосомы. Одновременно к комплексу рибосома-иРНК могут присоединиться только две тРНК с аминокислотами.
Благодаря специфическому связыванию антикодонов тРНК с кодонами иРНК, к участку молекулы иРНК, находящемуся в туннеле, присоединяются только молекулы тех тРНК, у которых антикодоны комлементарны кодонам иРНК. Поэтому эти тРНК доставляют в рибосомы только строго определенные аминокислоты. Далее аминокислоты соединяются друг с другом пептидной связью и образуется дипептид, который связан с одной из тРНК. После этого рибосома передвигается вдоль иРНК ровно на один кодон (это перемещение рибосомы называется транслокацией).
В результате транслокации свободная (без аминокислоты) тРНК отщепляется от рибосомы, а в зоне туннеля появляется новый кодон, к которому присоединяется по принципу комплементарности еще одна тРНК с аминокислотой, соответствующей этому кодону. Доставленная аминокислота соединяется с ранее образовавшимся дипептидом, что приводит к удлинению пептидной цепи. Далее следуют новые транслокации, поступление на рибосому новых тРНК с аминокислотами и дальнейшее удлинение пептидной цепи.
Таким образом порядок включения аминокислот в синтезируемый белок определяется последовательностью кодонов в иРНК.
Завершается синтез полипептидной цепи при поступлении в туннель особого кодона, который не кодирует аминокислоты и к которому не может присоединиться ни одна тРНК. Такие кодоны называются терминирующими или нонсенс-кодонами. Особенно велика их роль в синтезе белков, молекула которых состоит из нескольких полипептидов.
В конечном итоге, за счет описанных трех этапов синтезируются полипептиды, т.е. формируется первичная структура белка. Высшие (пространственные) структуры (вторичная, третичная, четвертичная) возникают самопроизвольно. Это объясняется тем, что пространственные структуры фиксируются, в основном, химическими связями, возникающими между радикалами аминокислот. Поэтому в каждом белке эти связи образуются специфически в соответствии с генетически обусловленной последовательностью расположения радикалов в полипептидных цепях.
В некоторых случаях полипептидная цепь после завершения синтеза подвергается незначительной химической модификации, в результате чего в ней появляются некодируемые аминокислоты (не относящиеся к 20 обычным аминокислотам). Например, при синтезе белка коллагена на рибосомах образуется его предшественник – проколлаген, содержащий в большом количестве аминокислоты лизин и пролин. Эти аминокислоты, находящиеся в составе полипептидной цепи, подвергаются в ходе модификации окислению и превращаются соответственно в оксилизин и оксипролин, что приводит к переходу проколлагена в коллаген.
Синтез белков - процесс энергоемкий. Для включения в молекулу синтезируемого белка только одной аминокислоты требуется не менее 3 молекул АТФ.
В очень небольших количествах белки еще синтезируются в митохондриях, где также имеются ДНК, и-РНК, т-РНК и рибосомы.
Синтез белков в организме ускоряется соматотропным гормоном (гормоном роста) и тестостероном (мужским половым гормоном). Тормозится синтез белков гормонами коры надпочечников – глюкокортикоидами. Регулирующее действие всех этих гормонов связано с их влиянием на скорость транскрипции.
Синтез белков подавляют многие антибиотики, ингибирующие трансляцию.
Азотистый баланс
Состояние белкового обмена можно оценить по азотистому балансу. Азотистый баланс это соотношение между азотом, поступающим в организм с пищей, и азотом, выводимом из организма в составе мочи, кала, пота, слюны.
Взрослый человек при обычном питании находится в состоянии азотистого равновесия (азота выводится столько, сколько поступает с пищей). Это свидетельствует об одинаковой скорости распада и синтеза белков.
При положительном азотистом балансе с пищей азота поступает больше, чем выводится. В этом случае синтез белков протекает с более высокой скоростью, чем их распад. Положительный азотистый баланс наблюдается у растущего организма, а также у спортсменов, наращивающих мышечную массу.
При отрицательном азотистом балансе (азота выводится больше, чем поступает) белков в организме распадается больше, чем образуется. Отрицательный азотистый баланс может быть при длительном белковом голодании.
Помимо синтеза белков аминокислоты еще используются для синтеза различных небелковых соединений, имеющих важное биологическое значение. Так, из аминокислот синтезируется глюкоза, азотистые основания, небелковая часть гемоглобина - гем, гормоны - адреналин и тироксин и очень важные соединения, участвующие в энергообеспечении мышечной работы – креатин и карнитин.
Часть аминокислот подвергается распаду и превращается в конечные продукты: CO2, H2O и NH3.
Распад начинается с реакций, общих для большинства аминокислот. К ним относятся:
а) Декарбоксилирование - отщепление от аминокислот карбоксильной группы в виде углекислого газа:
R R




 H - C - NH2 H - C - NH2
H - C - NH2 H - C - NH2
COOH - CO2 H
Амин
Это превращение аминокислот обычно протекает с очень низкой скоростью и аминов образуется мало. Но некоторые амины, находясь в очень низкой концентрации, обладают высокой биологической активностью и влияющие на различные функции организма. Примером такого амина является гистамин, образующийся из аминокислоты гистидина:







 СН2 N СН2 N
СН2 N СН2 N



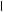


 H - C - NH2 H - C - NH2
H - C - NH2 H - C - NH2


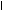





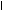 COOH NH - CO2 Н NH
COOH NH - CO2 Н NH
Гистидин Гистамин
Биологическая активность гистамина проявляется в том, что под его воздействием расширяются кровеносные сосуды, в первую очередь, мелкие, что приводит к снижению кровяного давления; увеличивается секреция желудочного сока. Кроме этого гистамин участвует в формировании болевых ощущений и в развитии аллергических реакций.
Однако серьезной опасности для организма биогенные амины не представляют, так как в организме имеются ферменты, разрушающие обезвреживающие амины. Поэтому проявление биологической активности аминов возможно лишь при их значительной выработке или при снижении активности ферментов, вызывающих их детоксикацию.
б) Дезаминирование - отщепление аминогруппы в виде NH3. У человека дезаминирование аминокислот идет окислительным путем:

 R R
R R



 H - C - NH2 + 1/2 O2 C = O
H - C - NH2 + 1/2 O2 C = O
 COOH - NH3 COOH
COOH - NH3 COOH
a -кетокислота
Дезаминирование аминокислот также протекает с низкой скоростью. И только одна аминокислота – глутаминовая дезаминируется с высокой скоростью вследствие наличия в организме активного фермента, вызывающего дезаминирование только этой аминокислоты:
COOH COOH

 CH2 + 1/2 O2 CH2
CH2 + 1/2 O2 CH2




 CH2 - NH3 CH2
CH2 - NH3 CH2

 H-C-NH2 C=О
H-C-NH2 C=О
COOH COOH
Глутаминоая кислота a-кетоглутаровая кислота
в) Трансаминирование (переаминирование) - реакция между аминокислотами и a-кетокислотами. В ходе этой реакции ее участники обмениваются функциональными группами, в результате чего аминокислота превращается в a-кетокислоту, а кетокислота становится аминокислотой:
 R1 R2 R1 R2
R1 R2 R1 R2






 H-C-NH2 + C = O ¾¾® C =O + H-C-NH2
H-C-NH2 + C = O ¾¾® C =O + H-C-NH2
 COOH COOH COOH COOH
COOH COOH COOH COOH
Трансаминированию подвергаются все аминокислоты. В этой реакции участвует кофермент - фосфопиридоксаль, для образования которого необходим витамин В6 - пиридоксин.
Трансаминирование - это главное превращение аминокислот в организме, так как его скорость значительно выше, чем у реакций декарбоксилирования и дезаминирования.
Трансаминирование выполняет две основные функции:
а) За счет трансаминирования одни аминокислоты могут превращаться в другие. При этом общее количество аминокислот не меняется, но изменяется соотношение между ними. С пищей в организм поступают чужеродные белки, у которых аминокислоты находятся в иных пропорциях по сравнению с белками организма. Путем трансаминирования происходит корректировка аминокислотного состава организма.
б) Трансаминирование является составной частью косвенного (непрямого) дезаминирования аминокислот - процесса, с которого начинается распад большинства аминокислот. На первой стадии этого процесса аминокислоты вступают в реакцию трансаминирования с a-кетоглутаровой кислотой (a-кетокислота). Аминокислоты при этом превращаются в a-кетокислоты, а a-кетоглутаровая кислота переходит в глутаминовую кислоту (аминокислота). На второй стадии появившаяся глутаминовая кислота подвергается дезаминированию, от нее отщепляется NH3 и снова образуется a-кетоглутаровая кислота.
Схема косвенного дезаминирования:  |
Итоговое уравнение косвенного дезаминирования совпадает с уравнением прямого дезаминирования:
R R




 H - C - NH2 + 1/2 O2 C = O
H - C - NH2 + 1/2 O2 C = O
COOH - NH3 COOH
Однако у косвенного дезаминирования скорость значительно выше, чем у прямого, что обусловлено высокой активность ферментов, катализирующих обе стадии этого процесса.
Отсюда вытекает, что реакцией, с которой начинается распад аминокислот в организме, является трансаминирование.
Образовавшиеся a-кетокислоты далее подвергаются глубокому распаду и превращаются в конечные продукты CO2 и H2O. Для каждой из 20 кетокислот (их образуется столько же, сколько имеется видов аминокислот) имеются свои специфические пути распада. Однако при распаде некоторых аминокислот в качестве промежуточного продукта образуется пировиноградная кислота, из которой возможен синтез глюкозы. Поэтому аминокислоты, из которых возникают такие кетокислоты, получили название «глюкогенные». Другие же кетокислоты при своем распаде не образуют пирувата. Промежуточным продуктом у них является ацетил-кофермент А, из которого невозможно получить глюкозу, но зато могут синтезироваться кетоновые тела. Аминокислоты, соответствующие таким кетокислотам, называются «кетогенные».
Второй продукт косвенного дезаминирования аминокислот - аммиак. Для организма аммиак является высоко токсичным. Поэтому в организме имеются молекулярные механизмы его обезвреживания.
9.6. Обезвреживание аммиака.
По мере образования NH3 связывается во всех тканях с глутаминовой кислотой с образованием глутамина:
 COOH CONH2
COOH CONH2

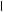
 CH2 СH2
CH2 СH2
 СH2 + NH3 + АТФ CH2
СH2 + NH3 + АТФ CH2


 H - C - NH2 - АДФ H - C - NH2
H - C - NH2 - АДФ H - C - NH2
 COOH - H3PO4 COOH
COOH - H3PO4 COOH
Глутаминовая Глутамин
кислота
Это временное обезвреживание аммиака. С током крови глутамин поступает в печень, где распадается опять на глутаминовую кислоту и NH3.Образовавшаяся глутаминовая кислота с кровью снова поступает в органы для обезвреживания новых порций аммиака. Освободившийся аммиак, а также углекислый газ в печени используются для синтеза мочевины.
Синтез мочевины - циклический, многостадийный процесс, потребляющий большое количество энергии. В синтезе мочевины очень важное участие принимает аминокислота орнитин. Эта аминокислота не входит в состав белков. Образуется орнитин из другой аминокислоты – аргинина, которая присутствует в белках. В связи с важной ролью орнитина синтез мочевины получил название «орнитиновый цикл».
В процессе синтеза к орнитину присоединяются две молекулы аммиака и молекула углекислого газа, и орнитин превращается в аргинин, от которого сразу же отщепляется мочевина, и вновь образуется орнитин:
 |
Наряду с орнитином и аргинином в образовании мочевины еще участвуют аминокислоты: глутамин и аспарагиновая кислота. Глутамин является поставщиком аммиака, а аспарагиновая кислота его переносчиком.
Синтез мочевины - это окончательное обезвреживаниеаммиака. Из печени с кровью мочевина поступает в почки и выделяется с мочой. В сутки образуется 20-35 г мочевины. Выделение мочевины с мочой характеризует скорость распада белков в организме.
В обобщенном виде обмен белков можно отразить следующей схемой:
 2015-10-22
2015-10-22 8687
8687