2. Оксиды
Оксидами называются сложные вещества, состоящие из атомов двух элементов, одним из которых является кислород со степенью окисления -2.
Если требуется составить формулу оксида ванадия (+5), необходимо найти наименьшее общее кратное между степенями окисления ванадия (+5) и кислорода (-2), взятыми по модулю. Наименьшим общим кратным чисел 5 и 2 является 10. Если наименьшее общее кратное 10 разделить на 5, получится число атомов ванадия в молекуле (2), если наименьшее общее кратное 10 разделить на 2, получится число атомов кислорода в молекуле оксида ванадия (+5). Соответствующая формула V2O5 означает, что в одной молекуле содержится 2 атома ванадия и 5 атомов кислорода.
2.1. Общие способы получения оксидов
1) Непосредственное взаимодействие веществ с кислородом:
4Al + 3O2  2Al2O3 (1)
2Al2O3 (1)
Коэффициенты показывают количество каждой молекул в химическом уравнении.
2) Термическое разложение некоторых кислот, оснований и некоторых солей (обычно это относится к плохо растворимым в воде веществам):
2Fe(OH)3  Fe2O3 + 3H2O (2)
Fe2O3 + 3H2O (2)
H2CO3  CO2 + H2O (3)
CO2 + H2O (3)
CaCO3  CaO + CO2 (4)
CaO + CO2 (4)
2.2. Общие свойства оксидов
Оксид взаимодействует с водой, если соответствующий гидроксид (кислота или основание) растворим в воде (Приложение 3 – таблица растворимости):
Na2O + H2O  2NaOH (P) (5)
2NaOH (P) (5)
BaO + H2O  Ba(OH)2 (P) (6)
Ba(OH)2 (P) (6)
MgO + H2O  не взаимодействует, поскольку гидроксид магния нерастворим в воде
не взаимодействует, поскольку гидроксид магния нерастворим в воде
SO3 + H2O  H2SO4 (P) (7)
H2SO4 (P) (7)
SiO2 +H2O  не взаимодействует, поскольку кремниевая кислота нерастворима в воде
не взаимодействует, поскольку кремниевая кислота нерастворима в воде
ОснОвными называются оксиды, которые взаимодействуют с кислотами и не взаимодействуют с основаниями:
CaO + 2HCl  CaCl2 + H2O (8)
CaCl2 + H2O (8)
Основные оксиды образуют металлы с небольшими степенями окисления (как правило, +1 и +2).
Кислотными называются оксиды, которые взаимодействуют с основаниями и не взаимодействуют с кислотами:
CO2 + Ca(OH)2  CaCO3 + H2O (9)
CaCO3 + H2O (9)
Кислотные оксиды образуют неметаллы, а также металлы с большими степенями окисления (+5, +6, +7).
Амфотерными называются оксиды, которые взаимодействуют и с кислотами, и с основаниями:
ZnO + 2HCl  ZnCl2 + H2O (10)
ZnCl2 + H2O (10)
ZnO + 2NaOH + H2O  Na2[Zn(OH)4] (11)
Na2[Zn(OH)4] (11)
Амфотерные оксиды образуют металлы со степенями окисления (+2, +3, +4).
3. Электролитическая диссоциация
Электролитическая диссоциация – это самопроизвольный распад молекул на ионы в растворе или в расплаве. Электролит – вещество, которое способно распадаться на ионы.
Если растворить в воде поваренную соль (хлорид натрия), то молекула распадется на катион натрия и хлорид-анион:
NaCl 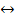 Na+ + Cl- (12)
Na+ + Cl- (12)
Уравнение диссоциации (12) не является химическим уравнением (1-11), потому что при диссоциации не образуется нового вещества.
Степень диссоциации (α) – отношение количества молекул, распавшихся на ионы, к общему количеству растворенных молекул. (Приложение 4 – степени диссоциации электролитов).
Сильный электролит полностью распадается на ионы, то есть α=1. Примером сильного электролита является хлорид натрия (12).
При диссоциации слабого электролита меньше половины растворенных молекул распадаются на ионы, то есть α<0,5.
CH3COOH 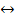 CH3COO- + H+ (13)
CH3COO- + H+ (13)
Простые вещества и оксиды, как правило, электролитами не являются.
 2021-12-25
2021-12-25 1300
1300
