В выражении констант равновесия всегда используются данные о составе равновесной реакционной смеси, т.е. исключительно в момент равновесия. При этом состав реакционной смеси может быть выражен через парциальные давления, концентрации, мольные доли и количества молей компонентов. Константы равновесия, выраженные через опытно определяемые количественные характеристики состава равновесной смеси, называют эмпирическими.
Стандартная термодинамическая константа равновесия безразмерная величина:
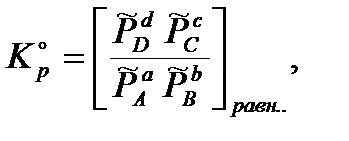
где 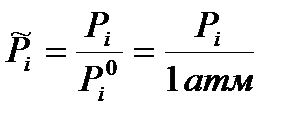 - обезразмеренное парциальное давление соответствующего компонента. Если в выражение для стандартной термодинамической константы равновесия подставить просто парциальные давления, то получим эмпирическую константу равновесия, которая будет иметь размерность давления в степени Δν= d+c –(a+b):
- обезразмеренное парциальное давление соответствующего компонента. Если в выражение для стандартной термодинамической константы равновесия подставить просто парциальные давления, то получим эмпирическую константу равновесия, которая будет иметь размерность давления в степени Δν= d+c –(a+b):
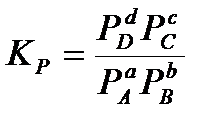 .
.
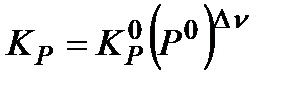 , где P o – давление в 1 атм., выраженное в соответствующих единицах:
, где P o – давление в 1 атм., выраженное в соответствующих единицах: 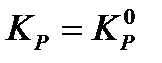 , если эмпирическая константа
, если эмпирическая константа 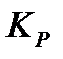 выражена в атм.Δν, если эмпирическая константа
выражена в атм.Δν, если эмпирическая константа 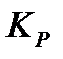 выражена в ПаΔν, то
выражена в ПаΔν, то 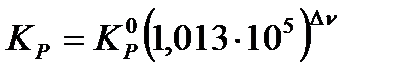 .
.
Используя уравнение состояния идеального газа, выразим парциальные давления через концентрации: 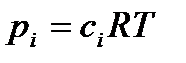 . Тогда:
. Тогда:
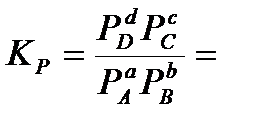
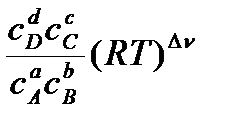 =
= 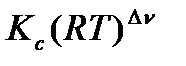
Величина 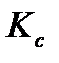 , как и
, как и 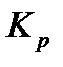 зависит только от температуры, но не зависит от общего давления. Если парциальные давления выражены в атм., а концентрации в моль/л, то в данном выражении следует использовать универсальную газовую постоянную в подходящей размерности R =0,082 л∙атм /моль ‧К.
зависит только от температуры, но не зависит от общего давления. Если парциальные давления выражены в атм., а концентрации в моль/л, то в данном выражении следует использовать универсальную газовую постоянную в подходящей размерности R =0,082 л∙атм /моль ‧К.
Парциальное давление можно выразить через общее давление по закону Дальтона: Pi= xi‧P, где 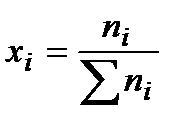 - мольная доля соответствующего компонента. Тогда:
- мольная доля соответствующего компонента. Тогда:
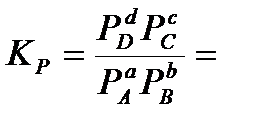
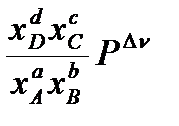 =
= 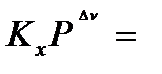
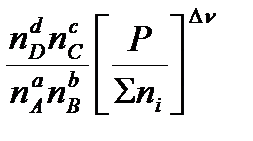 =
= 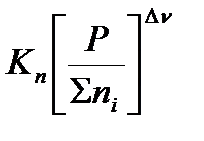 .
.
Из этих формул можно выразить эмпирические константы через термодинамическую:
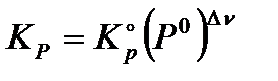 ;
; 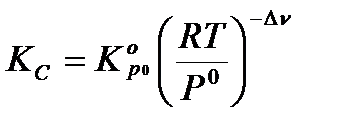 ;
; 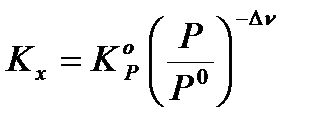 ;
; 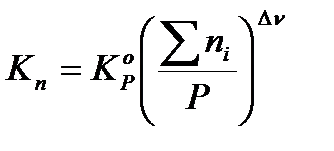
Вопросы и задачи:
1. От чего зависит величина термодинамической константы равновесия.
2. Имеются три реакции: a) N2O4=2 NO2; б) 1/2N2O4= NO2; в) 2 NO2= N2O4. Для первой реакции Кр=10, какова будет эта константа для двух остальных реакций.
3. При смешении 1моль спирта и 1 моль этанола протекает реакция образования эфира и воды. При достижении равновесия в реакционной смеси находятся по 1/3 моль кислоты и спирта и по 2/3 моль эфира и воды. Вычислить какое количество эфира, которое будет в реакционной смеси при достижении равновесия при условиях, когда смешали:
А) 1 моль кислоты и 2 моля спирта;
Б) 1 моль кислоты, 1 моля спирта и 1 моль воды;
В) 1 моль эфира и 3 моль воды;
Г) 1 моль кислоты, 1 моля спирта, 1 моль эфира и 1 моль воды.
3’. В эвакуированный сосуд с объемом 0,25 л поместил 1,5‧10-3 моль I2 и
нагрели до температуры 8000С. Йод испарился и частично продиссоциировал, после чего давление в ампуле стало 436 мм рт. ст. Определить Кр и Кс.
4. При 500 К константа равновесия реакции: PCl5↔ PCl5+ Cl3, Кр=0,33 атм. Определить степень диссоциации PCl5, если при достижении равновесия общее давление стало 0,8атм.
5. При каком общем давлении степень диссоциации станет 70 %.
 2021-12-25
2021-12-25 198
198







