Уравнение изотермы химической реакции (изотерма Вант-Гоффа)
Для того чтобы оценить возможность самопроизвольного протекания реакции и охарактеризовать удаленность системы от состояния равновесия, а также найти величину полезной работы, которую можно получить при обратимом проведении реакции, надо рассчитать Δ G для превращения стехиометрических количеств веществ в реакционной смеси данного состава при постоянстве P и T или Δ A при постоянстве V и T.
Рассмотрим самопроизвольно протекающую газофазную реакцию при постоянстве P и T:
aA+bB ⇄ cC+dD
Будем считать, что участвующие в ней вещества являются идеальными газами и находятся в таких количествах, что убыль реагентов и образование продуктов реакции в смеси по стехиометрии не приводят к изменению состава и условий существования системы. Это означает, что если в исходной смеси идеальных газов парциальные давления были p A, p B, p C, p D, то после одного пробега реакции, т.е. после превращения стехиометрических количеств веществ эти давления практически не изменятся.
Изменение энергии Гиббса данной реакции равно разности между энергией Гиббса продуктов и исходных веществ.
∆𝑟 G P,T = G прод. – G исх. = с G С + d G D - a G A - b G B,
где Gi – мольные энергии Гиббса, соответствующих компонентов или их химические потенциалы.
Для идеальных газов: 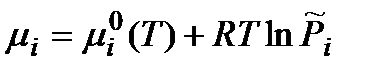 , где
, где 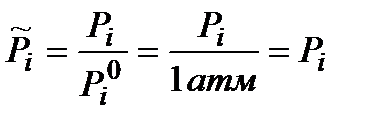 (атм.),
(атм.),
Тогда:
∆𝑟 G P,T = 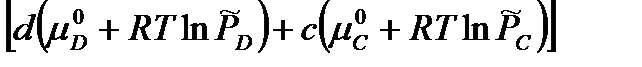 -
- 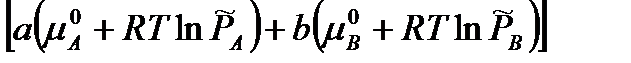 .
.
Раскрывая скобки, получим уравнение, которое называется изотермой химической реакции или изотермой Вант-Гоффа:
∆𝑟 G P,T = 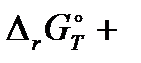
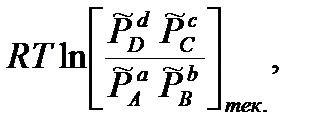
где 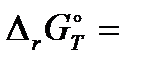
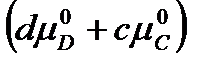 -
- 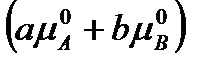 , а индекс «тек.» указывает на то, что берутся текущие парциальные давления в рассматриваемой газовой смеси.
, а индекс «тек.» указывает на то, что берутся текущие парциальные давления в рассматриваемой газовой смеси.
Если исходная смесь все компоненты в стандартных условиях, т.е. p A = p B = p C = p D = 1 атм, то ∆𝑟 G P,T = 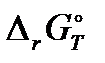 . Следовательно
. Следовательно 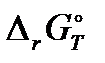 - стандартное изменение энергии Гиббса.
- стандартное изменение энергии Гиббса.
Уравнение изотермы Вант-Гоффа позволяет оценить принципиальную возможность протекания реакции. Если ∆𝑟 G P,T >0, то реакция идет в сторону образования исходных веществ, если ∆𝑟 G P,T <0, то реакция идет в прямом направлении. Если ∆𝑟 G P,T =0, то наступает равновесие. В этом состоянии давления всех компонентом становятся равновесными:
0= 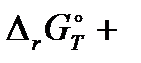
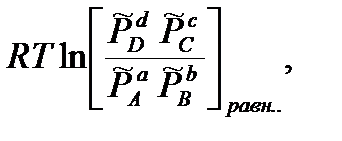
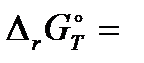 -
- 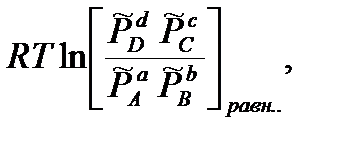
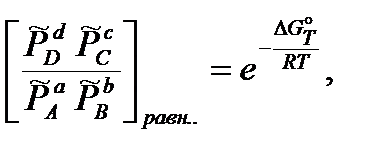
Правая часть этой формулы зависит только от температуры, следовательно и и левая часть будет константой при постоянной температуре. Эту константу называют стандартной термодинамической константой равновесия:
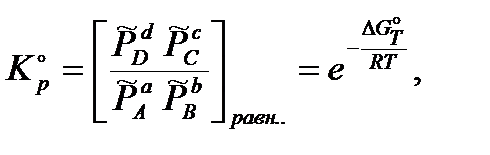
Выражение констант равновесия через давления, концентрации или активности называют в настоящее время законом действующих масс. В данном выражении индекс «р» означает, что константа равновесия выражена через равновесные давления.
Полученные выражения являются частным случаем уравнения изотермы Вант-Гоффа и позволят связать константу равновесия со стандартным изменением энергии Гиббса реакции. Благодаря этому можно рассчитать 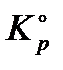 , не проводя трудоемких экспериментов по изучению равновесия, как это делал Макс Боденштейн.
, не проводя трудоемких экспериментов по изучению равновесия, как это делал Макс Боденштейн.
В соответствии с вышесказанным, исходя из того, что 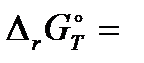
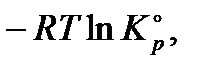 уравнение изотермы Вант-Гоффа можно записать еще двумя способами:
уравнение изотермы Вант-Гоффа можно записать еще двумя способами:
∆𝑟 G P,T = 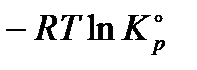 +
+ 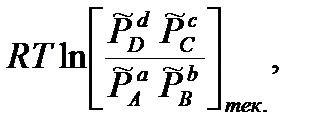
∆𝑟 G P,T = 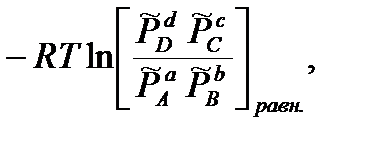 +
+ 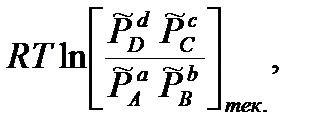
Если обозначить 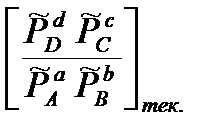 через П, то
через П, то
∆𝑟 G P,T = 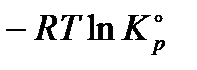 +
+ 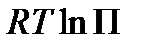 =
= 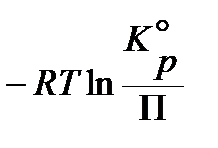 .
.
 2021-12-25
2021-12-25 91
91







