Пример 4.1.2
Найти молярную концентрацию и молярную концентрацию эквивалента 15-% (по массе) раствора H2SO4 (r = 1.10 г/см3).
Решение.
Для вычисления молярной концентрации найдем массу серной кислоты, приходящуюся на 1000 г воды:
На 85 г воды 15-% раствора приходится 15 г серной кислоты, а
1000 г ¾ х г
 г М (Н2SO4) = 98 г/моль,
г М (Н2SO4) = 98 г/моль,

Для расчета молярной концентрации и молярной концентрации эквивалента найдем массу серной кислоты, содержащуюся в 1000 мл раствора, т.е. в 1000*1.10 = 1100 г:
в 100 г ¾ 15 г 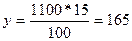 г.
г.
в 1100 г ¾ у
Масса эквивалента серной кислдоты равна 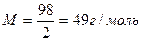 , следовательно,
, следовательно, 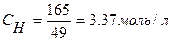 ,
, 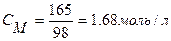 .
.
4.1.1. Контрольные задания 41 - 50.




 Заполните графы таблицы. Представьте полностью приведенные расчеты.
Заполните графы таблицы. Представьте полностью приведенные расчеты.
 Ва-ри-ант
Ва-ри-ант
| Вещество | Концентрация раствора
массовая молярная молярная доля, w % концентра- концентра ция СМ, ция экви- моль/л валента СН, моль/л
| Плот-ность раство-ра, r г/см3 | Объем раствора V, л | ||
 41. 41.
| CaBr2*6H2O | 1.02 | 0.50 | |||
 42. 42.
| Al(NO3)3*9H2O | 1.12 | 0.30 | |||
 43. 43.
| AgNO3 | 0.65 | 1.09 | 0.20 | ||
 44. 44.
| H3PO4 | 1.07 | 1.05 | 0.25 | ||
 45. 45.
| MnCl2 | 0.25 | 1.05 | 0.60 | ||
 46. 46.
| AlCl3*6H2O | 0.30 | 1.11 | 0.50 | ||
 47. 47.
| Na2SO4*10H2O | 0.90 | 1.10 | 1.00 | ||
 48. 48.
| KMnO4 | 0.40 | 1.04 | 0.80 | ||
 49. 49.
| Ba(CH3COO)2 | 0.20 | 1.03 | 0.30 | ||
| 50. | NiCl2 | 0.30 | 1.08 | 1.50 | ||

4.2. Растворы электролитов.
Растворы, проводящие электрический ток, называются растворами электролитов. Носителями электрических зарядов в таких растворах являются ионы, образующиеся при распаде (диссоциации) молекул кислот, оснований и солей под действием полярных молекул растворителя. Кислоты распадаются на катионы водорода и анионы кислотных остатков:
HNO3 «H+ + NO3-
Многоосновные кислоты диссоциируют ступенчато:
Н3РО4 «H+ + Н2РО4-
Н2РО4- «H+ + НРО42-
НРО42- «H+ + РО43-
Основания диссоциируют на гидроксид-анион и катионы металлов:
NH4OH «NH4+ + OH-
Соли диссоциируют на катионы металлов и анионы кислотных остатков:
CuSO4 «Cu2+ + SO42-
Na3PO4 «3 Na+ + PO43-
Количественными характеристиками процесса электролитической диссоциации являются степень и константа диссоциации.
Степенью диссоциации a называется отношение числа (концентрации) распавшихся на ионы молекул к общему числу молекул в растворе. Степень диссоциации зависит от природы электролита, концентрации и температуры раствора.
a =  (4.7)
(4.7)
В зависимости от степени диссоциации электролиты подразделяются на сильные и слабые.
Константа диссоциации - это константа равновесия процесса диссоциации
KatAn «Katz + + Anz -
[Katz +] [Anz -]
 KД = (4.8)
KД = (4.8)
[KatAn]
Константа диссоциации определяется только природой электролита и температурой раствора и не зависит от исходной концентрации. Константа диссоциации существует только для слабых электролитов. Степень диссоциации, константа диссоциации и концентрация раствора связаны законом разведения Оствальда:
С a2
 КД = ; (4.9)
КД = ; (4.9)
1 - a
при a «1 выражение приобретает вид: КД = С a2.
Электролитическая диссоциация воды.
Уравнение диссоциации молекулы воды:
2 Н2О «Н3О+ + ОН-
Упрощенно обычно представляют диссоциацию так:
Н2О «Н+ + ОН-
Для обратимого процесса диссоциации воды константа диссоциации имеет вид:
[H+] [OH-]
 КРАВН. = = 1.8*10-16
КРАВН. = = 1.8*10-16
[H2O]
и носит название константа диссоциации КДИСС.
Принимая во внимание, что [H2O] = 1000: 18 = 55.56 моль/л, объединяя постоянные величины в выражении КРАВН., получим, что произведение концентрации ионов [H+] [OH-] = 10-14 и носит название ионного произведения воды, КВ., или КW.
Для количественной характеристики сред можно использовать следующие величины: а) концентрация ионов водорода [H+]; б) водородный показатель, рН.
| Концентрация ионов [H+], моль/л | Среда | рН = - lg[H+] |
| 10-7 | нейтральная | - lg 10 -7 |
| > 10-7 | кислая | < 7 |
| < 10-7 | щелочная | > 7 |
рОН = - lg[ОH-] - гидроксильный показатель.
рН + рОН = 14.
 2022-01-07
2022-01-07 354
354








