ЛЕКЦИЯ 1
Содержание
| ЛЕКЦИЯ 1 Тема: s - Элементы I группы | |
| 1. Общая характеристика элементов I А группы. | 7 |
| Особенности лития и его соединений | |
| 2. Водород. Получение. Физические и химические свойства. Особенности положения в периодической системе | 15 |
| 3. Вода и ее свойства. Экологическое и биологическое значение воды | |
| 4. Пероксид водорода. Окислительно-восстановительная двойственность Н2О2 | |
| 5. Биогенные свойства элементов I А группы | |
| ЛЕКЦИЯ 2 Тема: s – Элементы II группы | |
| 1. Общая характеристика элементов II А группы. Физические и химические свойства щелочноземельных металлов (Ca, Sr, Ba) их бинарных соединений, гидроксидов и солей. Способы получения | |
| 2. Особенности соединений бериллия | |
| 3. Жесткость воды и ее влияние на живые организмы | |
| 4. Важнейшие соединения (в практическом отношении) элементов II А группы | |
| 5. Биогенная роль элементов II-А группы. Применение в сельском хозяйстве | |
| ЛЕКЦИЯ 3 Тема: p – Элементы III группы | |
| 1. Общая характеристика элементов III-A группы | |
| 2. Бор. Получение. Химические свойства | |
| 3. Алюминий | |
| 4. Биогенная роль | |
| ЛЕКЦИЯ 4 Тема: р - Элементы IV группы | |
| 1. Общая характеристикаIV-A группы | |
| 2 Химия углерода | |
| 3. Химия кремния | |
| 4.Химия германия, олова, свинца (Ge, Sn, Pb) | |
| 5. Биогенная роль | |
| ЛЕКЦИЯ 5 Тема: р - Элементы V группы | |
| 1. Общая характеристика элементов V-А группы | |
| 2. Химия азота | |
| 3. Химия фосфора | |
| 4. Биогенная роль | |
| ЛЕКЦИЯ 6 Тема: р - Элементы VI группы | |
| 1. Общая характеристика элементов VI-A группы | |
| 2. Химия кислорода | |
| 3. Химия серы | |
| 4. Биогенная роль | |
| ЛЕКЦИЯ 7 Тема: р - Элементы VII группы (галогены) | |
| 1.Общая характеристика элементовVII-A | |
| 2.Особые свойства фтора, как наиболее электроотрицательного элемента | |
| 3.Способы получения галогеноводородов и их свойства | 137 |
| 4.Кислородсодержащие соединения галогенов | |
| 5.Биогенная роль (фтор и йод как микроэлементы) |
Тема: s - Элементы I группы
В периодической системе всего 14 s -элементов (включая водород и гелий). Это элементы I А и II А групп. Элементы I А группы – щелочные металлы Li, Na, K, Rb, Cs, Fr. Все они имеют на внешнем электронном уровне атома по одному электрону ns1, сильно удаленному от ядра, с низким потенциалом ионизации. Всегда проявляют степень окисления +1.
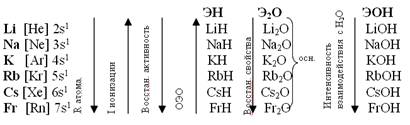
Сверху вниз в подгруппе возрастает радиус атома элементов за счет возникновения новых электронных уровней.
В группах по мере увеличения числа энергетических уровнейатомные радиусы растут. Переход нейтрального атома в катион 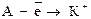 , сопровождается уменьшением радиуса поскольку в катионе заряд ядра удерживает меньшее число электронов. Очевидно, с возрастанием заряда ионный радиус катиона будет падать.
, сопровождается уменьшением радиуса поскольку в катионе заряд ядра удерживает меньшее число электронов. Очевидно, с возрастанием заряда ионный радиус катиона будет падать.
Энергия ионизации– это та энергия, которую необходимо затратить на отрыв внешнего электрона у невозбужденного атома. Строение внешних оболочек ns1, поэтому они имеют низкие энергии ионизации, уменьшающиеся при переходе по подгруппе сверху вниз. Связь электрона с ядром ослабевает при этом за счет увеличения радиуса атома и экранирования заряда ядра предшествующими внешнему электрону оболочками, увеличивается расстояние электрона от ядра и энергия ионизации уменьшается.
С ростом заряда ядра от Na к Fr усиливаются восстановительные свойства, это самые активные металлы. Их стандартные электродные потенциалы j° отрицательные и имеют большое абсолютное значение. Наиболее отрицателен j° лития равный -3,02 В по сравнению с ионами других щелочных металлов (ион Li+ имеет среди них наименьший радиус), хороший комплексообразователь. Энтальпия гидратации катионов лития велика (∆Н° гидрат.= - 486,6 кДж/моль). Чем меньше алгебраическая величина потенциала, тем выше восстановительная способность этого металла и тем ниже окислительная способность его ионов. Металлический литий – самый сильный восстановитель, а ион Li+ самый слабый окислитель.
 2014-02-13
2014-02-13 2086
2086