Кислородсодержащие органические соединения – соединения, содержащие помимо углерода и водорода, еще один элемент – кислород.
Атом кислорода содержится в различных функциональных группах, определяющих принадлежность соединения к конкретному классу.
К кислородосодержащим органических соединениям относится большой класс органических соединений: спирты, фенолы, альдегиды, кетоны, карбоновые кислоты, простые и сложные эфиры, и т.д.
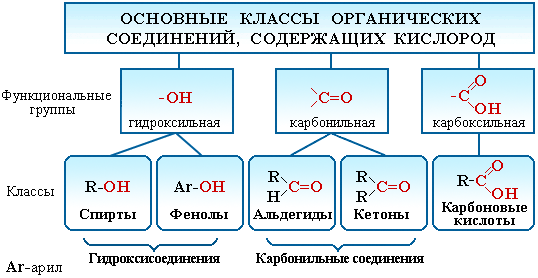
Соединения каждого класса образуют различные производные. Например, к производным спиртов относятся простые эфиры ROR', к производным карбоновых кислот – сложные эфиры RCOOR', амиды RCONH2, ангидриды (RCO)2O, хлорангидриды RCOCl и т.д.
Кроме того, большую группу составляют гетерофункциональные соединения, содержащие различные функциональные группы:
- гидроксиальдегиды HO–R–CHO,
- гидроксикетоны HO–R–CO–R',
- гидроксикислоты HO–R–COOH и т.п.
К важнейшим гетерофункциональным кислородсодержащим соединениям относятся углеводы Cx(H2O)y, молекулы которых включают гидроксильные, карбонильные и производные от них группы.
Строение и, следовательно, свойства соединений кислорода определяются характером его химических связей и типом гибридизации, влияющей на форму молекулы.
| Тип гибридизации кислорода | Электронная конфигурация | Число гибридных орбиталей | Валентный угол |
| sp3 | 1s2(2sp3)6 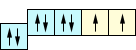 | 108,5° | |
| sp2 | 1s2(2sp2)52p1 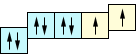 | 120° |
За счет двух одноэлектронных АО кислород способен к образованию двух ковалентных связей с другими атомами по обменному механизму. В этом случае кислород проявляет валентность 2 и имеет две неподеленные электронные пары. Такой атом кислорода может выступать донором пары электронов, образуя третью связь по донорно-акцепторному механизму. При этом кислород приобретает валентность 3 и заряд +1 (например, в ионе гидроксония H3O+ или алкилгидроксония RH2O+).
Такое взаимодействие кислородсодержащих соединений играет важную роль при проведении реакций в присутствии сильных минеральных кислот в качестве катализаторов (кислотный катализ).
Положительно заряженный атом кислорода может участвовать в образовании ионной связи. Например, в хлориде метилгидроксония:
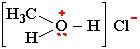
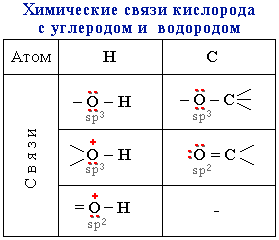
Электроотрицательности кислорода, водорода, углерода, соответственно, равны 3.5, 2.1 и 2.5. Поэтому связи кислорода с Н или С являются ковалентными полярными.
В этих связях электронная плотность смещена к более электроотрицательному атому кислорода, создавая на нем частичный отрицательный заряд, а на углероде или водороде - частичный положительный.
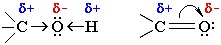
Распределение электронной плотности на атомах молекулы определяет ее реакционную способность: полярный характер связей кислорода с водородом и углеродом способствует гетеролитическому их разрыву и протеканию реакций по ионному механизму.
 2014-02-24
2014-02-24 19792
19792
