Эквивалентная электропроводность ( λ ) – это электропроводность раствора, содержащего 1 моль экв электролита, измеренная при расстоянии между электродами l = 1 см.
Единица измерения λ– См×см2/моль экв.
λ нельзя измерить, её рассчитывают:
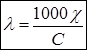 ,
,
где С – молярная концентрация эквивалента.
Факторы, влияющие на λ:
1. Природа электролита:
λ = α (λ+ + λ–),
где α – степень диссоциации;
λ+ и λ– – подвижности ионов:
λ+ = F × U ±,
где F – число Фарадея;
U ± – скорости движения ионов.
В разбавленных растворах при С ® 0 степень диссоциации α ® 1, следовательно:
λ0 = λ+0 + λ–0 (закон независимого движения ионов, уравнение Кольрауша),
где λ0 – предельная электропроводность (при бесконечном разбавлении);
λ+0 и λ–0 – предельные подвижности ионов (индивидуальные характеристики ионов, приведены в таблицах).
2. Температура (t о): чем больше t о, тем больше λ.
3. Концентрация электролита (С): чем больше С, тем меньше λ.
Для разбавленного раствора сильного электролита при z± = 1:
λ = λ0 – В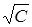 (уравнение Онзагера),
(уравнение Онзагера),
где В – константа.
Как видно из уравнения Онзагера, для получения линейной зависимости лучше всего строить график в координатах λ = f (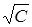 ) (рис. 13).
) (рис. 13).

Рис. 13. Зависимость эквивалентной электропроводности от концентрации
При этом:
· в разбавленных растворах зависимость λ = f (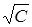 ) – линейная;
) – линейная;
· в концентрированных – наблюдаются отклонения от линейности по тем же причинам, что и для χ.
 2014-02-13
2014-02-13 2694
2694
