Нанотехнологии открывают новые возможности в клинической лабораторной диагностике. Молекулярная диагностика способствует формированию персонализированной медицины - современного направления, в основе которого лежит составление индивидуального генотипического и фенотипического портрета пациента. Кроме того, преимуществами использования нанотехнологии в лабораторной диагностике являются возможность использования очень небольших количеств биологического материала, высокая скорость и чувствительность лабораторных тестов и, наконец, возможность одновременного проведения диагностики и лечения.
Нанобиотехнологии в лабораторной диагностике
Нанобиочипы. В настоящее время микрочипы широко используются для выявления полиморфизмов и мутаций. Усилия исследователей в течение последних лет были направлены на миниатюризацию биочипов с целью обеспечения максимальной плотности нанесения биологического материала. Недавно разработанная технология поиска и идентификации полиморфизмов и мутаций в геноме человека, основанная на применении наночастиц золота.
Атомно-силовая микроскопия. В основе метода атомно-силовой микроскопии лежит принцип профилометра (рис. 3). При этом заостренный пирамидальный наконечник, присоединенный к кронштейну, движется по поверхности изучаемого объекта, обеспечивая формирование трехмерного изображения объекта на экране регистрирующего устройства. Кронштейн, на котором располагается наконечник, состоит из двух слоев – золотого зеркала и слоя силикона. Двухмерное изображение (ширина и длина объекта) достигается за счет отсчета расстояния, пройденного кронштейном, а третье измерение (глубина или высота) формируется путем отражения лазерного пучка и фиксации полученных значений двойным фотодиодом.
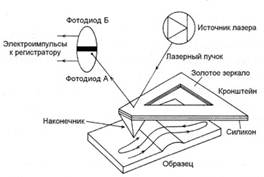
Рис. 3. Принцип работы атомного силового микроскопа (по Pereira, 2001).
Aтомно-силовая микроскопия имеет некоторые преимущества перед методом сканирующей электронной микроскопии, традиционно используемой для получения поверхностных изображений биологических объектов высокого разрешения. При сканирующей электронной микроскопии изображение объекта формируется за счет детекции электронов, отраженных объектом. При этом поверхность объекта должна быть электропроводной, что в большинстве случаев достигается путем напыления тонкого слоя металла на образец. Процедура напыления приводит к маскированию некоторых структур клеточной оболочки и, кроме того, клетки образца теряют жизнеспособность в ходе его приготовления. Изобретение атомно-силовой микроскопии позволило избежать этих проблем, поскольку в данном случае не требуется покрытие образца слоем металла и вполне возможно наблюдение живых клеток. При этом разрешающая способность атомно-силовой микроскопии не уступает традиционной сканирующей электронной микроскопии.
Aтомно-силовая микроскопия может использоваться не только для визуализации клеток и субклеточных структур, но и для детекции молекулярных структур. Метод атомно-силовой микроскопии является перспективным и в плане направленной доставки лекарственных препаратов, поскольку в этом случае препарат может быть доставлен не только в отдельную клетку, но и в определенный внутриклеточный участок.
Методы цитогенетики используются для характеристики структуры хромосом и их аномалий. Использование флуоресцентной гибридизации позволило добиться хороших результатов. В настоящее время молекулярная цитогенетика получила новый импульс к развитию, что связано главным образом с использованием атомно-силовой микроскопии и флуоресцентной гибридизации на основе квантовых точек. Атомно-силовая микроскопия позволяет получить информацию об ультраструктуре хромосом и одновременно осуществлять препаровку мельчайших участков хромосом.
Нанобиодатчики. Нанобиодатчики представляют собой наноразмерные датчики для качественного и количественного определения химических веществ и определенных типов клеток в биологическом материале. Нанобиодатчики обладают исключительно высокой чувствительностью по сравнению с другими типами датчиков
Типы нанодатчиков:
· электронные нанодатчики
· электрохимические нанодатчики
· нанодатчики, основанные на переключении ионных каналов
· нанопроволочные датчики
· наноконсоли
· нанодатчики на основе нанотрубок
· кремнеземные наночастицы
· датчики, инкапсулированные в биологически локализованный материал
· нанодатчики на основе вирусных частиц
Одним из вариантов являются нанопроволоки. Поскольку поверхность нанопроволоки легко поддается химической модификации, в настоящее время освоены методы нанесения на нее распознающих элементов для различных молекул. Присоединение молекулы-мишени к поверхности нанопроволоки вызывает немедленное изменение ее электропроводности, которое может учитываться количественными методами. Легированная бором силиконовая нанопроволока использовалась для создания высокочувствительных количественных датчиков биологического назначения.
Другой тип нанодатчиков основан на технологии переключения ионных каналов. Датчик представляет собой синтетическую самосборную мембрану, функционирующую по принципу биологического прерывателя. Электрический импульс от датчика генерируется при контакте с искомой биологической молекулой.
Диагностическая система «Biodetect» (Integrated NanoTechnologies, США) функционирует за счет электронного распознавания связывания искомой молекулы ДНК с чувствительным элементом микрочипа. Молекула ДНК при этом формирует мостик между двумя струнами нанопроволоки. Образование ДНК-мостиков, наличие которых контролируется с помощью методов флуоресцентной визуализации, легко распознается путем измерения сопротивления или других электрических свойств нанодатчика.
Некоторые нанодатчики основаны на использовании вирусных частиц. Так, в частности, вирус герпеса и аденовирус использовались для запуска самосборки магнитных нанозерен, обеспечивающих детекцию других вирусов в биологических средах. Нанозерна состояли из магнитного ядра, представленного оксидом железа, и декстрановой оболочки. Далее к поверхности нанозерен присоединялись антитела против вируса герпеса. Облучение диагностической системы магнитным полем обеспечивало чрезвычайно чувствительную детекцию вирусных частиц, например, 5 вирусных частиц в объеме сыворотки 10 мл.
Датчики, инкапсулированные в биологически локализованный материал (ДИБЛМ), состоят из сенсорных молекул, погруженных в химически инертный матрикс путем микроэмульсионной полимеризации, что обеспечивает образование сферических нанодатчиков диаметром от 20 до 200 нм. Эти датчики обеспечивают внутри- и межклеточную детекцию различных ионов и молекул в режиме реального времени, причем формирующийся при этом сигнал не подвергается интерференции со стороны белковых молекул. ДИБЛМ также демонстрируют хорошую устойчивость к выщелачиванию и фотовыцветанию.
Нанотехнологии и молекулярная визуализация
Как и традиционная диагностика, нанодиагностика преследует цель возможно более раннего выявления заболевания, в идеале, на молекулярном уровне. В связи с этим в наномедицине появился термин «молекулярная визуализация». Молекулярная визуализация возможна при использовании следующих видов диагностических исследований:
- Оптическая молекулярная визуализация
- Компьютерная томография.
- Магнитно-резонансная томография (МРТ).
- Однофотонная эмиссионная компьютерная томография.
- Позитронно-эмиссионная томография.
Оптическая молекулярная визуализация. Для оптической молекулярной визуализации чаще всего используются квантовые точки. Они представляют собой неорганические флуоресцентные наночастицы, имеющие целый ряд преимуществ по сравнению с органическими флуоресцентными метками. Kвантовые точки могут быть идеальным инструментом для молекулярной визуализации у животных. Диагностическая ценность квантовых точек существенно возрастает при обеспечении их селективной доставки в определенный орган или ткань без нарушения их функции. Направленная доставка квантовых точек становится возможной при их конъюгации с пептидами или антителами. В клинической медицине эта методика может применяться для визуализации поверхностных тканевых образований (опухоли кожи и подкожной клетчатки), интраоперационной диагностики и визуализации зон, доступных при эндоскопии.
В силу отсутствия тканеспецифических контрастных агентов, компьютерная томография до настоящего времени не рассматривалась как метод молекулярной визуализации. Тем не менее, в последние годы появились исследования, в которых в качестве контрастных агентов для компьютерной томографии использовались наночастицы. Так, йод-содержащие наночастицы в исследовании обеспечивали хорошую визуализацию макрофагов в атеросклеротических бляшках аорты кролика. Есть основания ожидать, что использование этих наночастиц может стать важным элементом компьютерной томографии коронарных артерий у человека.
МРТ. Определенные перспективы связаны с использованием наночастиц в качестве альтернативы традиционным контрастным агентам для магнитно-резонансной томографии. Для этой цели использовались суперпарамагнитные наночастицы оксида железа, которые подвергаются неспецифическому захвату клетками ретикуло-эндотелиальной системы. В связи с этим, наночастицы оксида железа применялись для визуализации печени, селезенки и лимфоузлов. Суперпарамагнитные наночастицы оксида железа хорошо обнаруживаются даже при их очень низкой концентрации. Имеются данные о визуализации отдельных клеток, содержащих эти наночастицы, и даже индивидуальных наночастиц. Поэтому данный тип наночастиц в последнее время активно используется для мечения отдельных клеток и прослеживания путей их миграции.
Однофотонная эмиссионная компьютерная томография и позитронно-эмиссионная томография. В большинстве выполненных к настоящему времени исследований наноплатформ для однофотонной эмиссионной компьютерной томографии и позитронно-эмиссионной томографии изучалась возможность направленной доставки наночастиц, меченых радиоизотопами, к опухолевой ткани с целью ее визуализации. Например, наночастицы оксида железа, меченые изотопом 111In и содержащие моноклональные антитела, исследовались на модели рака молочной железы у мышей. Эти наночастицы обеспечивали оптимальную детекцию опухоли и, после их нагревания за счет облучения переменным магнитным полем, вызывали термолизис (разложение) опухолевой ткани (рис. 4)
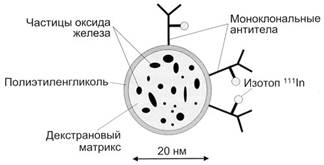
Рис. 4. Схема строения гибридной наночастицы, предназначенной для диагностики и терапии опухолей
 2014-02-17
2014-02-17 2150
2150








