Варианты постановки ИФА
Общий принцип. В настоящее время используется огромное количество модификаций ИФА. Широкое распространение получили разные варианты твердофазного иммуноферментного анализа. Основные принципы твердофазного ИФА, независимо от модификации, заключаются в следующем:
1. На 1 этапе реакции адсорбируют антигены или антитела на твердой фазе. При этом не связавшиеся с твердой фазой реагенты легко удаляются отмыванием.
2. В сенсибилизированных лунках инкубируют исследуемый образец. В лунках с положительным контролем – стандартные реагенты. При этом на поверхности твердой фазы формируются иммунные комплексы. Несвязавшиеся компоненты удаляют отмыванием.
3. При добавлении конъюгата антитело-фермент или антиген-фермент и связывании его с иммобилизованным иммунным комплексом активный центр фермента остается доступным для последующего взаимодействия с субстратом. Инкубация субстрата в лунках с иммобилизованным конъюгатом приводит к развитию цветной реакции. Эту реакцию можно остановить на нужной стадии, выраженность окрашивания можно оценить визуально или по оптической плотности.
Прямой ИФА. 1. В лунках панелей адсорбируют антигены или антитела (исследуемый материал).
2. Блокируют свободные места связывания, оставшиеся на твердой фазе, с помощью БСА казеина и др. (для предотвращения неспецифической сорбции конъюгата на твердой фазе).
3. В лунки вносят меченные ферментом антитела или антигены (конъюгат), инкубируют. Связывание конъюгата с твердой фазой будет происходить лишь в случае комплементарности обоих компонентов системы. После инкубации с коньюгатом лунки отмывают, удаляя, таким образом, не связавшуюся часть конъюгата.
4. Затем в лунки вносят субстрат, специфичный для используемого фермента, и инкубируют. По достижении оптимального уровня окрашивания в лунках с положительным контролем, ферментативную реакцию останавливают.
5. Учет реакции. Сначала результаты реакции учитывают визуально. Для более точного учета результатов интенсивность окрашивания оценивают на ИФА-ридере с соответствующим светофильтром. По результатам проведенного анализа строят график зависимости оптической плотности от концентрации.
Непрямой ИФА. Этот вариант ИФА используют обычно для выявления специфических АТ.
1. Антиген адсорбируют на твердой фазе, затем отмывают от несвязавшихся компонентов.
2. Блокируют свободные места связывания. Отмывают.
3. В лунки вносят исследуемый материал, инкубируют и затем проводят процедуру отмывки. Параллельно ставят пробы с положительным и отрицательным контролями.
4. Добавляют антиглобулиновый конъюгат в рабочем разведении, инкубируют, отмывают от несвязавшихся компонентов.
5. Вносят субстрат, инкубируют. По достижении оптимального уровня окрашивания в лунках с положительным контролем реакцию останавливают, добавляя стоп-раствор.
6. Измеряют количество продукта реакции на ИФА-ридере (рис.3).
При оптимальных условиях проведения анализа метод высокоспецифичен и чувствителен. Он позволяет выявлять нанограммовые количества антител в сыворотках исследуемых больных.
«Сэндвич» – вариант ИФА для выявления антигенов. Антигены, определяемые с помощью данного варианта ИФА, должны иметь несколько эпитопов, способных связывать антитела, или обладать повторяющимися, пространственно разделенными эпитопами одинаковой специфичности.
При проведении этого варианта ИФА высокоспецифичные поли- или моноклональные антитела, адсорбированные на твердой фазе, инкубируют с исследуемым образцом. После процедуры отмывания в лунки вносят меченные ферментом антитела (конъюгат) к тому же антигену и далее проводят все остальные этапы реакции.
Конкурентный ИФА. Этот вариант анализа основан на конкуренции меченых (конъюгат) и немеченых (исследуемых) антител за связывание с антигеном, адсорбированным на твердой фазе. Количество фермента, присоединившегося к твердой фазе, уменьшится пропорционально содержанию в смеси свободных антител. Для определения антигена используется тот же вариант, но в этом случае искомый антиген конкурирует с меченым, стандартным антигеном за связывание с антителами, иммобилизованными на поверхности твердой фазы.
Этот вариант ИФА применяется для определения различных соединений, таких как иммуноглобулины человека, раково-эмбриональный антиген, инсулин и др. Он позволяет выявлять антитела к диагностически значимым эпитопам инфекционных агентов.
В этом случае количество антигена в исследуемом образце обратно пропорционально ферментативной активности на твердой фазе.
Ингибиторный ИФА. В этом варианте ИФА антиген, присутствующий в исследуемом образце, связывается с моноклональными антителами, меченными ферментной меткой, и ингибирует их взаимодействие со стандартным антигеном, иммобилизованным на твердой фазе. Присутствие в образце даже следовых количеств специфичного к конъюгату антигена будет ингибировать связывание меченых антител с иммобилизованным антигеном. Степень ингибирования прямо пропорциональна содержанию антигена в растворе.
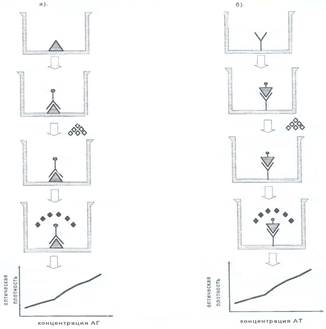
Рисунок 2. Прямой ИФА.
а) для выявления антигена; б) для выявления антител.
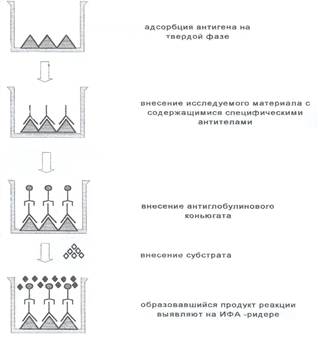
Рисунок 3. - Непрямой ИФА для выявления антител.
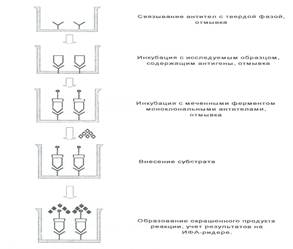
Рисунок 4. «Сэндвич»- вариант ИФА.
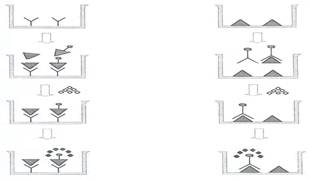
Рисунок 5. Конкурентный ИФА и ингибиторный ИФА
В мембране эритроцитов человека содержится более 300 различных антигенных детерминант, молекулярное строение которых закодировано соответствующими генными аллелями хромосомных локусов. Количество таких аллелей и локусов в настоящее время точно не установлено. Две важнейшие классификации группы крови человека — это система AB0 и резус-система. Известно также 46 классов других антигенов, из которых большинство встречается гораздо реже, чем AB0 и резус-фактор.
Система AB0. Известно несколько основных групп аллельных генов этой системы: A¹, A², B и 0. Генный локус для этих аллелей находится на длинном плече хромосомы 9. Основными продуктами первых трёх генов — генов A¹, A² и B, но не гена 0 — являются специфические ферменты гликозилтрансферазы, относящиеся к классу трансфераз. Эти гликозилтрансферазы переносят специфические сахара — N-ацетил-D-галактозамин в случае A¹ и A² типов гликозилтрансфераз, и D-галактозу в случае B-типа гликозилтрансферазы. При этом все три типа гликозилтрансфераз присоединяют переносимый углеводный радикал к альфа-связующему звену коротких олигосахаридных цепочек. Структура олигосахаридов H-антигена, отвечающего за группы крови системы АВ0. Субстратами гликозилирования этими гликозилтрансферазами являются, в частности и в особенности, как раз углеводные части гликолипидов и гликопротеидов мембран эритроцитов, и в значительно меньшей степени — гликолипиды и гликопротеиды других тканей и систем организма. Именно специфическое гликозилирование гликозилтрансферазой A или B одного из поверхностных антигенов — агглютиногена — эритроцитов тем или иным сахаром (N-ацетил-D-галактозамином либо D-галактозой) и образует специфический агглютиноген A или B. В плазме крови человека могут содержаться агглютинины α и β, в эритроцитах — агглютиногены A и B, причём из белков A и α содержится один и только один, то же самое — для белков B и β.
Таким образом, существует четыре допустимых комбинации; то, какая из них характерна для данного человека, определяет его группу крови: α и β: первая (0); A и β: вторая (A); α и B: третья (B); A и B: четвёртая (AB).
Система Rh (резус-система). Резус крови — это антиген (белок), который находится на поверхности красных кровяных телец (эритроцитов). Он обнаружен в 1940 году Карлом Ландштейнером и А.Вейнером. Около 85 % европейцев (99 % индейцев и азиатов) имеют резус и соответственно являются резус-положительными. Остальные же 15 % (7 % у африканцев), у которых его нет, — резус-отрицательный. Резус крови играет важную роль в формировании так называемой гемолитической желтухи новорожденных, вызываемой вследствие резус-конфликта иммунизованной матери и эритроцитов плода. Известно, что резус крови — это сложная система, включающая более 40 антигенов, обозначаемых цифрами, буквами и символами. Чаще всего встречаются резус-антигены типа D (85 %), С (70 %), Е (30 %), е (80 %) — они же и обладают наиболее выраженной антигенностью. Система резус не имеет в норме одноименных агглютининов, но они могут появиться, если резус-отрицательному человеку перелить резус-положительную кровь.
На данный момент изучены и охарактеризованы десятки групповых антигенных систем крови, таких, как системы Даффи, Келл, Кидд, Льюис и др. Количество изученных и охарактеризованных групповых систем крови постоянно растёт.
Келл. Групповая система Келл (Kell) состоит из 2 антигенов, образующих 3 группы крови (К—К, К—k, k—k). Антигены системы Келл по активности стоят на втором месте после системы резус. Они могут вызвать сенсибилизацию при беременности, переливании крови; служат причиной гемолитической болезни новорождённых и гемотрансфузионных осложнений.
Кидд Групповая система Кидд (Kidd) включает 2 антигена, образующих 3 группы крови: lk (a+b-), lk (A+b+) и lk (a-b+). Антигены системы Кидд также обладают изоиммунными свойствами и могут привести к гемолитической болезни новорожденных и гемотрансфузионным осложнениям. так же это зависит от гемоглобина в крови.
Даффи Групповая система Даффи (Duffy) включает 2 антигена, образующих 3 группы крови Fy (a+b-), Fy (a+b+) и Fy (a-b+). Антигены системы Даффи в редких случаях могут вызвать сенсибилизацию и гемотрансфузионные осложнения.
MNSs Групповая система MNSs является сложной системой; она состоит из 9 групп крови. Антигены этой системы активны, могут вызвать образование изоиммунных антител, то есть привести к несовместимости при переливании крови. Известны случаи гемолитической болезни новорождённых, вызванные антителами, образованными к антигенам этой системы.
9.2.2. Определение групповой и резу слой принадлежности крови человека.
Определение группы крови стандартными изогемагглютинирующими сыворотками. Используются любые белые пластинки (тарелки, пластик) со смачиваемой поверхностью или специальные планшеты. Пластинка маркируется надписью: слева — 0αβ, в центре — Аβ, справа — Вα. Под соответствующим обозначением группы крови на пластинку наносят по одной большой капле (0,1 мл) стандартной сыворотки соответствующей группы. Капля крови должна быть примерно в 10 раз меньше капли стандартной сыворотки (соотношение 1:10), с которой она смешивается сухой стеклянной палочкой. Кроме того, на нижнюю часть пластинки наносят в три точки по одной большой капле сыворотки (0, 1 мл) исследуемой крови, а рядом с ними - по одной маленькой капле (0, 01 мл) стандартных эритроцитов в следующем порядке слева направо: группа 0(I), А(II) и В(III), в ней определяются антитела.. Эритроциты группы 0(I) являются контролем, т. к. они не должны агглютинироваться никакой сывороткой. После размешивания капель в равномерно красный цвет пластинку покачивают, оставляют на 1 —2 мин в покое, а затем снова периодически покачивают. Не ранее чем через 3 мин в капли, в которых наступила агглютинация, добавляют по 1 капле (0,05 мл) физиологического раствора NaCl. Хотя агглютинация начинается в течение первых 10 — 30 с, наблюдение следует продолжать до 5 мин, после чего делается заключение о группе крови. Реакция гемагглютинации может быть положительной или отрицательной. Положительной реакцией считается наличие агглютинации, отрицательной — ее отсутствие. Результаты определений могут дать четыре различные комбинации положительных и отрицательных реакций: 1) если сыворотки всех трех групп дали отрицательную реакцию, то исследуемая кровь принадлежит к группе 0(I); 2) если сыворотки групп 0αβ и Вα дали положительную реакцию, то кровь принадлежит к группе А(II); 3) если сыворотки групп 0αβ и Аβ дали положительную реакцию, а сыворотка группы Вα — отрицательную, то исследуемая кровь принадлежит к группе В(III); 4) если сыворотки всех трех групп дали положительную реакцию, для исключения неспецифической агглютинации необходимо провести дополнительное исследование с сывороткой АВ0. Если Реакция с этой сывороткой также будет отрицательная, то исследуемая кровь относится к группе AB(IV). Оценка результатов определения групп крови при помощи стандартных изогемагглютинирующих сывороток приведена в таблице:
| Группа крови | Анти-A | Анти-B | Анти-АВ |
| 0(I) | - | - | - |
| A(II) | + | - | + |
| B(III) | - | + | + |
| AB(IV) | + | + | + |
| Группа крови | 0αβ(I) - анти-А+B | Aβ (II) - анти-B | Bα (III) - анти-A | AB0 (IV) |
| 0 (I) | - | - | - | + |
| А (II) | + | - | + | + |
| B (III) | + | + | - | + |
| AB (IV) | + | + | + | - |
Определение группы крови с помощью моноклональных антител (цоликлонов). Используются стандартные наборы моноклональных антител высокой специфичности, содержащие реагенты анти-А, анти-В и анти-АВ. На маркированную пластинку раскапываются в три точки исследуемые эритроциты (0,01—0,03 мл). Рядом с ними помещают реагенты анти-А, анти-В и анти-АВ по одной капле (0,1 мл) в соотношении 1: 5... 1: 6. Капли перемешивают стеклянной палочкой, пластинку периодически покачивают, ход реакции наблюдают в течение 3 мин. Оценка результата проводится по наличию агглютинации эритроцитов с соответствующим реагентом. При агглютинации во всех трех каплях определяется группа крови AB(IV). При агглютинации с анти-А и анти-АВ определяется группа крови А(II). При агглютинации с анти-В и анти-АВ определяется группа крови В(III). При отсутствии агглютинации во всех трех каплях определяется группа крови 0(I).
Знаком (+) обозначено наличие агглютинации, знаком (-) ее отсутствие. При наличии агглютинации со всеми тремя реагентами необходимо исключить неспецифическую агглютинацию исследуемых эритроцитов. Для этого к капле эритроцитов вместо цоликлонов добавляют каплю физиологического раствора. Кровь можно отнести к группе AB(IV) только при отсутствии агглютинации эритроцитов в физиологическом растворе. Реакция агглютинации на плоскости с помощью цоликлонов анти-D супер. Используется специальный реагент, содержащий мо-ноклональные антитела к резус-фактору (цоликлон анти-D супер или аналогичные). На пластинку или планшет наносят большую каплю (около и,1 мл; реагента, а рядом маленькую каплю (0,02 — 0,03 мл) исследуемых эритроцитов. Тщательно смешивают реагент с эритроцитами стеклянной палочкой. Через 10 — 20 с начинают мягко покачивать пластинку. Несмотря на то что четкая агглютинация наступает почти мгновенно, результаты реакции учитывают через 3 мин после смешивания. При наличии агглютинации исследуемая кровь маркируется как резус-положительная, при отсутствии — как резус-отрицательная.
Почитать: Острый антропонозный трансмиссивный протозооноз. Возбудители малярии — одноклеточные животные (простейшие), относятся к классу спорозоа, подклассу кокцидиа, семейству плазмодий, роду плазмодиум. У человека известно 4 вида возбудителей малярии: плазмодии вивакс (p. vivax) — возбудитель трехдневной малярии; плазмодии малярии (p. malariae) — возбудитель четырехдневной малярии; плазмодии фальсипарум (p. falciparum) — возбудитель тропической малярии; плазмодии овале (p. ovale) — возбудитель особой формы трехдневной малярии. Последний вид в естественных условиях встречается в Африке, Палестине, Южной Америке, на Филиппинах. В России существование овале не установлено. Человек в естественных условиях может заразиться через комаров возбудителем малярии обезьян.
Цикл развития малярийных возбудителей осуществляется со сменой хозяев: половое развитие (спорогония) протекает в организме окончательного хозяина — самки комара рода анофелес; бесполое развитие (шизогония) — в организме промежуточного хозяина — человека).
Спорогония — попавшие в желудок комара с кровью человека мужские и женские половые клетки плазмодиев (микро- и мак-рогаметоциты) превращаются в зрелые микро- и макрогаметы, которые после оплодотворения проходят ряд последовательных этаггов развития (от зиготы до спороцисты) инвазионных форм спорозоитов, накапливающихся в слюнных железах насекомого. Продолжительность спорогонии определяется видом плазмодиев и температурой окружающего воздуха. При оптимальной температуре воздуха (25 °С) спорогония продолжается 10 дней у плазмодиев вивакс, 12 дней - у фальсипарум и 16 дней -у малярие и овале. При температуре воздуха ниже 15 °С споро-зоиты не развиваются. Дальнейшее развитие спорозоиты получают в организме позвоночного хозяина, в который они проникают при кровососании комара.
В организме человека малярийные паразиты проходят бесполое размножение, или шизогонию: - в тканевых клетках — тканевая шизогония; - в эритроцитах — эритроцитарная шизогония. Тело малярийного паразита состоит из цитоплазмы и ядра. Некоторые стадии паразитов содержат пигмент, который окраски не воспринимает, а имеет свой естественный цвет: темно-бурый, золотисто-желтый, коричневый, почти черный (разный у разных видов паразитов). Заражение человека происходит в результате укуса зараженного комара рода анофелес. Со слюной такого комара в организм человека попадают спорозоиты. Тканевая шизогония протекает в клетках печени. Спорозоиты внедряются в них, округляются, растут, достигая в поперечнике 40—50 мкм и более. В них многократно делится ядро, а затем сегментируется цитоплазма. В результате образуются тканевые мерозоиты. Часть мерозоитов проникает в эритроциты и дает начало эритроцитарному циклу развития паразитов. Другие мерозоиты проникают вновь в клетки печени, в которых продолжается развитие тканевых форм. Стадии паразитов, развивающиеся в клетках печени, называют тканевыми, или экзоэритроцитарными, формами. Различают также формы преэритроцитарные, развитие которых в тканевых клетках проходит параллельно развитию эритроци-тарных форм. Минимальная продолжительность экзоэритрици-тарной шизогонии составляет 8 суток у пл. вивакс, 6 суток у пл. факсипарум, 9 суток у пл. овале и 19—16 суток у пл. малярие. Вследствие политипичности спорозоитов пл. вивакс и пл. овале часть из них (до 8—13 мес после инокуляции) обеспечивает развитие болезни после продолжительной инкубации или возникновение истинных или отдаленных рецидивов болезни. Эритроцитарная шизогония пл. вивакс, пл. малярии и овале протекает в периферической крови. Возбудитель пл. фальсипарум в периферической крови обычно встречаются только шизонты, кольца. Остальные стадии шизогонии вплоть до разделения паразита на мерозоиты и развития половых форм (гамоитов) протекают во внутренних органах. Только в случаях тяжелой коматозной малярии в периферической крови могут наблюдаться и другие стадии цикла шизогонии. У некоторых штаммов пл. фальсипарум все стадии шизогонии можно обнаружить в периферической крови у значительной части больных и при относительно легком течении болезни.
Размножение паразитов в эритроцитах протекает в виде регулярно сменяющихся циклов. От проникновения мерозоита в эритроцит до завершения развития паразита, заканчивающегося образованием новых мерозоитов, у пл. вивакс, пл. фальси-парум и пл. овале проходит 48 ч, у пл. малярие — 72 ч. Часть мерозоитов, проникающих в эритроциты, превращаются в мужские и женские половые клетки — гамонты (мужские — микрогамонты, женские — макрогамонты).
Женские гамонты достигают стадии полной зрелости — стадии гаметы в крови человека, мужские гаметы дозревают в организме переносчика. По завершении процесса созревания в желудке комара наблюдается процесс выбрасывания мужским гаме-тоцитом 4—8 мужских гамет, которые после отшнуровывания активно двигаются в содержимом желудка, способны проникать в женскую гамету и ее оплодотворять (половой процесс). При пл. фальсипарум гаметоциты сначала принимают округлую форму и лишь затем образуются микрогаметы. Оплодотворенные женские гаметы (зиготы) проникают сквозь эпителий средней кишки (желудка) комара и под наружной ее оболочкой образуют ооцисты. Ооцисты растут, в них формируется большое число спорозоитов — одноядерных веретеновид-ных образований (длина 11-15 мкм, ширина 1—1,5 мкм). Цисты разрываются, и из них выходят спорозоиты, которые, распространяясь с гемолимфой по тканям комара, попадают в его слюнные железы, после чего комар становится способным передавать малярию человеку. Заражение малярией может наступит не только через укус комара, но при переливании крови от донора, у которого в крови имеются паразиты, даже в весьма малом количестве.
10.2.1. Морфология возубудителей малярии человека в тонких мазках и толстых каплях.
Паразитологический диагноз малярии основан на обнаружении паразитов в окрашенных препаратах (толстая капля и мазок) крови. Паразиты могут присутствовать в крови не только во время лихорадочных приступов и промежутков между приступами, следующими один за другим, но и в течение длительных периодов, на протяжении которых не наблюдается повышения температуры.
Наличие паразитов в крови при отсутствии лихорадочных приступов называется паразитоносительством. Такие люди заразны для комаров. При массовых обследованиях следует брать кровь вне зависимости от наличия приступов. Техника приготовления и окраски мазка — мазок готовят как обычно. После того как мазок высохнет, его фиксируют в 96%-ном этиловом спирте 15 мин или в метиловом спирте в течение 3 мин. Высушенные после фиксации мазки окрашивают краской Романовского, разведенной дистиллированной водой, ркрашивают в течение 30—50 мин, в зависимости от качества краски. После окрашивания препарат споласкивают водой и высушивают на воздухе.
Техника приготовления и окраски толстой капли. На стекле приготовляют мазок, а потом на еще влажный мазок дают упасть капле крови. Капля равномерно растекается, образуя круг. После того как капля высохнет, на мазке простым карандашом делают соответствующую отметку. Препарат без фиксации окрашивают. Затем осторожно (чтобы не смыть каплю) препарат споласкивают водопроводной водой и высушивают. Мазки и толстые капли микроскопируют имммерсионной системой.
Морфология малярийных паразитов в мазке крови. Мерозоит, внедрившись в эритроцит, превращается в молодой шизонт, имеющий вид кольца. Затем паразит, увеличиваясь, принимает амебовидную форму, при этом сохраняется просвет (вакуоль) между ядром паразита и основной частью его цитоплазмы. В цитоплазме паразита появляются зерна пигмента. Амебовидный шизонт заполняет значительную часть эритроцита, затем начинает округляться, вакуоль исчезает (стадия подготовки к делению), пигмент начинает собираться в отдельные пучки. Для плазмодия малярии шизонты — лентовидные формы. Ядро паразита начинает делиться, а затем цитоплазма паразита делится так, что к каждому дочернему ядру прилегает отдельный комочек цитоплазмы (меруляция). В результате получается кучка мерозоитов — морула. Пигмент на стадии морулы собран в одну компактную кучу. У пл. фальсипарум скучивание пигмента наступает еще до полного формирования морулы. Мерозоиты расходятся, попадают в плазму крови, часть из них погибает, часть внедряется в новые эритроциты. Гамонты. Форма гамонтов у всех малярийных паразитов, за исключением тропической малярии, круглая или слегка овальная. При тропической малярии плазмодий имеет вытянутые гамонты с закругленными концами. Мужские и женские гамонты различаются между собой по величине и структуре ядра (интенсивности окраски цитоплазмы). Женские гамонты — ядро небольшое, компактное; цитоплазма красится в интенсивный голубой цвет. Мужские гамонты — ядро большое, цитоплазма красится бледно, часто зона вокруг ядра принимает фиолетовый оттенок.
Морфология малярийных паразитов в толстой капле. В толстой капле, поскольку ее окрашивают в нефиксированном виде, эритроциты выщелачиваются, а малярийные паразиты претерпевают значительную деформацию. При четырехдневной и тропической малярии пораженные эритроциты в толстой капле выщелачиваются полностью, так же как и нормальные. При трехдневной малярии в толстой капле строма эритроцитов сохраняется и диагностика малярийного паразита по толстой капле облегчается. Кольца в толстой капле обычно смяты, вытянуты в виде восклицательного знака, иногда разорваны в виде запятой. Амебовидные шизонты часто бывают уплотненными, лентовидные шизонты четырехдневной малярии в толстой капле округляются и неотличимы от амебовидных шизонтов. Морулы распознаются в толстой капле легко. Цитоплазма паразитов в результате воздействия химиотерапевтических препаратов окрашивается слабее, приобретает стекловидный оттенок, становится вакуолизированной, распадается на отдельные комочки, ядро становится рыхлым или, наоборот, более компактным. Иногда пигмент собирается в кучки, выталкивает из паразита. В толстых каплях распознавание таких подвергшихся деформации паразитов становится более трудным, а иногда и невозможным.
 2014-02-17
2014-02-17 2625
2625
