31. Определение электролитов и неэлектролитов. Основные положения теории
электролитической диссоциации. Сильные и слабые электролиты. Степень
диссоциации, факторы, влияющие на степень диссоциации слабых электролитов. Как изменится концентрация ионов Н+ в растворе уксусной кислоты при ее
разбавлении?
32. Кислоты, основания и соли в свете теории электролитической диссоциации.
Составьте уравнения диссоциации следующих электролитов:
а) сульфата аммония
б) бромоводородной кислоты
в) гидроксида кальция
г) гидрокарбоната натрия
33. Укажите условия, при которых реакции в растворах электролитов идут до конца.
Приведите примеры. Составьте молекулярные и ионные уравнения следующих ре акций:
а) тиосульфат натрия + серная кислота →
б) хлорид аммония + гидротартрат натрия →
34.Определение константы диссоциации. Напишите выражение константы
диссоциации следующих электролитов:
а) уксусной кислоты
б) синильной кислоты
в) гидроксида аммония
35. Определения раствора, растворителя, растворенного вещества. Что называется растворимостью вещества? Какой раствор называется ненасыщенным, насыщенным, пересыщенным? Как изменяется растворимость большинства твердых веществ:
а) при повышении температуры?
Б) при увеличении концентрации растворителя?
36. Что называется концентрацией раствора? Перечислите способы выражения концентрации раствора. Дайте определения, приведите формулы для расчетов. Вычислите нормальную и молярную концентрации 20% -го раствора NaOH, плотность которого при нормальных условиях равна 1,219 г/мл.
37. Химическое равновесие. Укажите условия смещения равновесия. Константа ице-ческого равновесия. Укажите фактор, влияющий на величину константы равновесия. Напишите выражение константы химического равновесия для реакции:
 FeCI3+3KCNS Fe(CNS)3+3KCI
FeCI3+3KCNS Fe(CNS)3+3KCI
В какую сторону сместится равновесие при увеличении концентрации раствора FeCI3? Как при этом изменится интенсивность окраски раствора?
38. Сущность химических, физико-химических и физических методов качественного анализа. В чём отличие «сухого» метода анализа от «мокрого»?
39. Какие реакции называются «аналитическими»? Признаки аналитических реакций. Общие, групповые, избирательные и специфические реакции.
40.Требования к качественным реакциям и условия их проведения. Специфичность реакций. Чувствительность реакций, какими величинами она характеризуется?
41. Сульфидный метод классификации катионов. Групповые реактивы и условия их ийствия. Сущность дробного и систематического метода анализа.
42. Общая характеристика катионов I аналитической группы. Их значение в
химико-технологическом контроле пищевых продуктов.
43. Общая характеристика катионов II аналитической группы, их значение в
химико-технологическом контроле пищевых продуктов. Условия действия
группового реактива на катионы II аналитической группы.
44. Диссоциация воды. Ионное произведение воды. Водородный показатель. Значения рН в кислой, щелочной и нейтральной среде.
45. Произведение растворимости. Что характеризует величина произведения растворимости? Значение произведения растворимости в аналитической химии. Как следует назвать раствор, в котором произведение растворимости:
а) больше произведения концентраций ионов электролита в растворе?
Б) меньше произведения концентраций ионов электролита в растворе?
В) равно произведению концентраций ионов электролита в растворе?
46. Условия образования и растворения осадка. Почему при действии на катионы II ицлитической группы групповым реактивом в присутствии NH4CI катионы Mg + остаются в растворе? Ответ подтвердите уравнениями реакций.
47. Общая характеристика катионов III аналитической группы. Их значение в химико-технологическом контроле пищевых продуктов. Условия действия группового реактива на катионы Ш аналитической группы.
48. Какой реактив используется для подавления гидролиза групповых реактивов П и III аналитических групп катионов? Ответ подтвердите уравнениями реакций.
49. Амфотерные основания. Приведите примеры амфотерных оснований. Составьте уравнения реакций, подтверждающие амфотерные свойства Zn (ОН)2
50. Сущность окислительно-восстановительных реакций и их отличия от реакций ионного обмена. Решите уравнение окислительно-восстановительной реакции методом электронного баланса, укажите окислитель и восстановитель;
СrCI3 + КОН + Н2О2 → К2СгO4 + КСI + Н2О
Что наблюдается в результате реакции?
51. Какие соединения называют комплексными и чем они отличаются от двойных солей? Какое значение имеют комплексные соединения в качественном анаиц и химико-технологическом контроле пищевых продуктов? Напашите уравнение диссоциации комплексного соединения: [Zn(NH3)4](OH)2. Укажите заряды комплексного иона и комплексообразователя, назовите координационное число.
52. Общая характеристика катионов IV аналитической группы. Их значение в
химико-технологическом контроле пищевых продуктов. Условия действия
группового реактива на катионы IV аналитической группы.
53. Классификация анионов. Действие групповых реактивов. Значение анионов в ицеико-технологическом контроле пищевых продуктов.
54. Понятие о количественном анализе, его значение в химико-технологическом контроле пищевых продуктов. Методы количественного анализа: физические, физико-химические и химические.
55. Сущность гравиметрического метода анализа. Операции гравиметрического метода анализа и их применение в химико-технологическом контроле пищевых продуктов. Вычисления в гравиметрическом методе.
56. Сущность и методы объемного анализа. Условия проведения анализа. Способы выражения концентрации растворов: нормальная концентрация, титр, титр по определяемому веществу: Приведите формулы для расчета этих величин.
57. Что называется нормальной концентрацией, титром раствора и титром по определяемому веществу? Приведите формулы расчета этих величин.
58. Каким требованиям должны удовлетворять реакции, применяемые при титровании? Какие растворы называются титрованными? Способы приготовления титрованных растворов. Что является установочным веществом, и какие требования к нему предъявляются?
59. Сущность метода нейтрализации. Понятие об индикаторах. Что такое интервал перехода индикатора?
60. Сущность окислительно-восстановительных методов, их применение в химико-технологическом контроле пищевых продуктов. Эквиваленты окислителей и восстановителей.
61.Сущность метода перманганатометрии. В какой среде проводят титрование перманганатом калия? Как определяется точка эквивалентности в перманганатометрии?
62. Какие реакции лежат в основе иодометрии? Какие стандартные растворы и индикаторы применяются в иодометрии? В чем сущность количественного определения окислителей и восстановителей в иодометрии? Применение иодометрии в химико-технологическом контроле пищевых продуктов.
63. Сущность метода осаждения и отличие его от гравиметрического метода. Каи требованиям должны удовлетворять реакции осаждения? Значение методов осаждения в химико-технологическом контроле пищевых продуктов.
64. Сущность метода Мора, его значение в химико-технологическом контроле
пищевых продуктов. Назовите рабочий раствор в методе Мора.
65. Назовите индикатор метода Мора. На чем основано его действие? Ответ
подтвердите уравнениями реакций.
66. Сущность комплексонометрического метода, охарактеризуйте комплексоны, назовите рабочий раствор в комплексонометрии. В каких анализах химико-технологического контроля пищевых продуктов используется метод комплексонометрии?
67. Что такое общая жесткость воды? В каких единицах измеряется? Какое отрицательное значение имеет жесткая вода? Какими методами определяется жесткая вода?
68. Сущность физико-химических методов анализа и их особенности. Применение этих методов в химико-технологическом контроле пищевых продуктов.
69. Сущность колориметрического метода анализа. На чем основан этот метод? Условия проведения колориметрического анализа. Способы колориметрии. Применение колориметрических методов анализа в химико-технологическом контроле пищевых продуктов.
70. Сущность методов стандартных серий и калибровочного графика. Какой из них точнее? Применение их в химико-технологическом контроле пищевых продуктов.
71. Катионы К+входят в состав молока. С помощью каких реакций можно обнаружить иатионы К+? Приведите соответствующие уравнения реакций.
72. При разложении белков мяса и рыбы (гниении) образуется аммиак. С помощью какого реактива можно быстро обнаружить присутствие катионов NH4? Составьте соответствующее уравнение реакции. Что наблюдается в результате реакции?
73. Для обнаружения мела при фальсификации меда в раствор меда добавляют какую-либо кислоту. Составьте соответствующее уравнение реакций. Что наблюдается в результате реакции?
74. Выявить наличие соды в чае можно добавлением любой кислоты. Составьте соответствующее уравнение реакции. Что наблюдается, если в чае присутствует сода?
75. Реакция осаждения катионов Са2+ оксалатом аммония используется для
определения полноты вложения молока в молочных супах. Составьте соответствующие уравнение реакции. В чем растворяется и не растворяется образующийся осадок?
76. Вычислите [Н+], определите рН среды и изменение окраски фенолфталеина,
если [ОН–] = 1·10-5 моль/л
77. Вычислите [ОН–], если рН раствора равен 6,0. Определите реакцию среды.
78. Вычислите [ОН–], определите рН среды сантинормального раствора NaOH.
79. Вычислите ПР Ag2CrO4 ,если растворимость этой соли при 22 °С равна
1,00·10-4 моль/л
80. Вычислите растворимость РbВr2, если ПР РbВr2 при 22°С равно 6,30·10-6
81. Вычислите концентрацию ионов Ag+ в насыщенном растворе AgCI, если
ПР AgCl=l,56·10-10
82. Как влияет на гидролиз соли (NH4)2S добавление NH4OH? Ответ подтвердите уравнениями реакций.
83. Как отделить катионы А13+ от катионов Мn2+,используя амфотерные свойства, и открыть катионы Mn2+? Ответ подтвердите уравнениями реакций.
84. Как отделить катионы Fe3+ от катионов Сг3+? Ответ подтвердите уравнениями реакций.
85. При глубоком гнилостном распаде белков мяса и рыбы образуются летучие соединения, одним из которых является сероводород. Определить присутствие сероводорода можно с помощью раствора ацетата свинца. Составьте соответствующее уравнение реакции, опишите условия проведения реакции. Что наблюдается в результате реакции?
86. При производстве крема для десертов иногда используются запрещенные синтетические красители, вредные для здоровья. Ярко – зеленая окраска свидетельствует о присутствии ядовитых медьсодержащих веществ, которые можно обнаружить путем добавления раствора аммиака, при этом поверхность продукта окрашивается в темно – синий цвет. Составьте уравнение соответствующей реакции.
87. Как определить в растворе анионы SO32- и СО32-? Ответ подтвердите уравнениями реакций.
88. Кислоты разлагают все сульфиты с выделением диоксида серы SO2. Выделяющийся SO2 взаимодействует с раствором KmnO4 реакция используется для определения общего количества SO2 в сыром очищенном сульфитированном картофеле. Составьте уравнения соответствующих реакций. Что наблюдается в результате реакций?
89. При определении гигроскопической воды в образце хлорида натрия (поваренной соли) получены следующие результаты: масса тигля – 7, 2393 г, масса тигля с навеской до прокаливания – 7,8809г, после прокаливания – 7,8616г. Определить массовую долю воды в образце.
90. Навеска сахара, массой 2,6248 г после высушивания до постоянной массы стаицеесить 2,5420 г. Определите массовую долю влаги в образце.
91. Определите влажность муки в образце, если до высушивания его масса была – 3,4589 г, а после высушивания – 2,9747 г.
92. Определите навеску молотого кофе до высушивания, если после удаления
влаги масса стала 2,7852 г. Влажность данного образца молотого кофе составляет 3,8 %
93. Раствор не окрашивается фенолфталеином, но окрашивается лакмусом в
синий цвет. Какие значения рН может иметь раствор?
94. Почему при титровании слабого основания сильной кислотой и слабой
кислоты сильным основанием точки эквивалентности не совпадают с точкой нейтральности?
95. Кислотность является одним из показателей качества полуфабрикатов из
муки, творога, соков, сиропов и характеризует степень их свежести. На титрование 50,00 мл пробы сока израсходовали 20,00 мл 0,1 н. раствора щёлочи.
Определите нормальную концентрацию кислоты в пробе и титр раствора NaOH по НCI.
96. К фильтрату вытяжки из творога, объемом 50,00 мл добавили 2-3 капли 1% - го спиртового раствора фенолфталеина и титровали 0,1 н. раствором щёлочи до слаборозового окрашивания. На титрование израсходовано 15,00 мл раствора NaOH. Определите нормальную концентрацию кислоты в фильтрате вытяжки и титр раствора NaOH.
97. К 50,00 мл фильтрата вытяжки из хлебобулочных изделий добавили 2-3 капли 1%-го спиртового раствора фенолфталеина и титровали 0,1н. раствором щёлочи до слаборозового окрашивания. На титрование было израсходовано 10,00 мл раствора NaOH. Определите титр раствора NaOH и титр раствора NaOH пo HCI.
98. Вычислите нормальную концентрацию и титр раствора H2SO4, если на титрование 50,00 мл раствора Nа2Соз, полученного растворением 0,50 г Na2CO3 (х.ч.) в мерной колбе объемом 200мл, израсходовано 24,00 мл раствора H2SO4.
99. На нейтрализацию 40,00 мл раствора серной кислоты израсходовано 24,00 мл 0,2 н. раствора щелочи NaOH. Какое количество H2SO4 содержится во взятом объеме раствора?
100. Что называется эквивалентом? Является ли эквивалентная масса одного и того же вещества в различных реакциях величиной постоянной? Рассчитайте эквивалентные массы H2SO4 в реакциях:
а) H2SO4 + 2 NaOH = Na2SO4 + 2Н2О
б) H2SO4 + NaOH = NaНSO4 + 2Н2О
101. Определите эквивалентные массы окислителя и восстановителя и решите уравнение окислительно-восстановительной реакции:
KmnO4+ Na2C2O4 + H2SO4=K2SO4+ MnSO4+ Na2SO4+ CO2+ H2O
102. Определите эквивалентные массы окислителя и восстановителя и решите уравнение окислительно-восстановительной реакции:
Cr2(SO4)3 + КОН + H2O2 = К2СгO4 + Н2О
103. Определите эквивалентные массы окислителя и восстановителя и решите уравнение окислительно-восстановительной реакции:
KmnO4 + Na2S2O3 + H2SO4=Na2SO4 + MnSO4 + K2SO4+H2O
104. На титрование 0,4500г щавелевой кислоты H2C2O4 · 2H2O, растворённой в произвольном количестве воды, израсходовали 15,00 мл. раствора КмnО4. Вычислите нормальную концентрацию и титр раствора КмnО4. Составьте уравнение соответствующей реакции.
105. На титрование 0,3594 г тиосульфата натрия Na2S2O3· 5H2O растворенного в произвольном количестве воды, израсходовали 21,88 мл раствора КмnО4. Вычислите нормальную концентрацию и титр раствора КмnО4. Составьте уравнение соответствующей реакции.
106. На титрование 10,00 мл раствора соли Мора израсходовали 15,00 мл 0,001 н. раствора КмnО4. Определите нормальную концентрацию раствора соли Мора и титр раствора КмnО4 по железу.
107. Для определения концентрации раствора КмnО4 необходимо приготовить 100,00 мл. 0,1н. раствора оксалата натрия Na2C2O4. Какую навеску соли Na2C2O4 требуется взять? Составьте уравнение соответствующей реакции.
108. Навеску Н 2С2О4 · 2 Н2О, массой 0,1518 г, растворили в произвольном количестве воды и оттитровали, израсходовав 24,56 мл раствора КмnО4. Определите титр и нормальную концентрацию раствора КмnО4.
109. Какую навеску КмnО4 следует взять для приготовления 200,00 мл. раствора, если титр КмnО4 по железу равен 0,005585г/мл.
110. Витамин С (аскорбиновая кислота С6Н8О6) определяют иодометрическим методом. Реакция идет по уравнению.
С6Н8О6 + I2= С6Н6О6+2HI
в присутствии крахмала в качестве индикатора. На титрование 5,00 мл пробы раствора витамина С израсходован 1,00 мл 0,1н. раствора I2. Определите нормальную концентрацию аскорбиновой кислоты в пробе и титр раствора I2.
111. Навеску дихромата калия К2Сг2О7 массой 0,0979 г растворили в мерной колбе объемом 100мл. На титрование 25,00 мл полученного раствора израсходовано 25,50 мл раствора тиосульфата натрия Na2S2O3·5Н2О. Вычислите титр и нормальную концентрацию раствора тиосульфата натрия.
112. На титрование раствора, приготовленного растворением 0,1020 гр. NаCI произвольном объёме воды, израсходовано 38,40 мл. раствора AgNO3. Определите нормальную концентрацию AgNО3 и титр раствора AgNО3 по хлору. Составьте уравнения реакций, которые происходят при титровании.
113. На титрование раствора NaCI расходуется 30,20 мл раствора AgNO3 (Т AgNO3=0,1245г/мл). Определите массу NaCI в растворе. Составьте уравнения реакций, которые происходят при титровании.
114. Сколько граммов NaCI содержится в 250,00мл. раствора, если на титрование 10,00 мл. этого раствора израсходовано 20,40 мл 0,05 н. раствора AgNO3?Составьте уравнения реакций, которые происходят при титровании.
115. Какую навеску AgNО3 необходимо взять для приготовления 250,00 мл. 0,1н. раствора AgNО3?
116. Для определения содержания поваренной соли в продукте, фильтрат вытяжки из творожных полуфабрикатов титрируют раствором азотнокислого серебра, титр которого равен 0,0292 г/мл. Определите нормальную концентрацию раствора AgNO3 и содержание AgNO3 в 250,00 мл раствора.
117. Вычислите нормальную концентрацию катиона Mg2+ в воде если при титровании 100,00 мл. воды тритоном Б(ЭДТА) с хромогеном черным до синей окраски израсходовано 19,70 мл. 0,1011н. раствора трилона Б.
118. Для установления титра рабочего раствора трилона Б(ЭДТА) взяли 0,6252 г обезвоженного СаСО3 и растворили в мерной колбе на 250,00 мл. На титрование 25,00мл этого раствора израсходовали 12,23 мл. раствора трилона Б. Определите нормальную концентрацию раствора трилона Б и титр его по кальцию.
119. Чему равна общая жесткость воды, если на титрование 100,00 мл её израсходовали 12,15 мл 0,1022н. раствора трилона Б(ЭДТА). Является ли эта вода жесткой или мягкой?
4. Концентрация стандартного раствора соли трёхвалентного железа равна 0,0100 мг/ мл, а высота слоя 30,30 мл. Определите концентрацию соли железа в 100,00мл анализируемого раствора, если высота слоя анализируемого раствора ровна 27,90 мл.
Перечень вопросов к экзамену:
1. Дайте понятие предмета, задач аналитической химии, ее назначении в подготовке технологов общественного питания.
2. Опишите основные положения теории электролитической диссоциации. Степень электролитической диссоциации.
3. Дайте понятие кислоты, основания, соли с точки зрения теории электрической диссоциации.
4. Дайте понятие закона действия масс, его применение в аналитической химии.
5. Охарактеризуйте методы аналитической химии.
6. Охарактеризуйте условия выполнения химических реакций.
7. Дайте определение чувствительности реакций.
8. Дайте понятие аналитическим реакциям.
9. Опишите технику выполнения отдельных операций полумикрометодом (нагревание, выпаривание, осаждение, проверка полноты осаждения).
10. Дайте понятие реакциям ионного обмена.
11. Дайте понятие сильным и слабым электролитам.
12. Охарактеризуйте аналитическую классификацию катионов (сульфидная).
13. Охарактеризуйте общую группу катионов I аналитической группы.
14. Напишите характерные реакции катиона Na+
15. Напишите характерные реакции катиона K+. Условия проведения реакции.
16. Напишите характерные реакции катионы 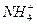 , условия проведения реакций.
, условия проведения реакций.
17. Дайте понятие гидролиза солей.
18. Понятие о Произведении растворимости (ПР). Насыщенные, пересыщенные и ненасыщенные растворы.
19. Дайте общую характеристику катионов II аналитической группы.
20. Дайте общую характеристику катионов II аналитической группы.
21. Напишите характерные реакции катиона Ca2+.
22. Напишите характерные реакции Ba2+
23. Напишите характерные реакции катиона Mg2+.
24. Дайте понятие об окислительно-восстановительных реакциях.
25. Охарактеризуйте комплексные соединения.
26. Дайте общую характеристику катионов III аналитической группы.
27. Опишите действие группового реактива на катионы III аналитической группы.
28. Напишите реакцию Al3+.
29. Напишите характерные реакции Fe3+.
30. Напишите характерные реакции Zn2+
31. Напишите характерные реакции Mn2+.
32. Напишите характерные реакции Cr3+.
33. Дайте понятие аналитическим смесям.
Основная литература
Жванко Ю.Н., Панкратова Г.В., Мамедова З.И., Аналитическая химия и технохимический контроль в общественном питании. – М.: Высшая школа, 1988.
Дополнительная литература
1. Барсукова З.А. Аналитическая химия. – М.: Высшая школа, 1990.
2. Воскресенский А.Г., Солодкин И.О., Семиколенов Г.Ф. – Сборник задач и упражнений по аналитической химии. – М.: Просвещение, 1985
3. Шапиро С.А., Шапиро М.А. Аналитическая химия / 3-е изд. – М.: Высшая школа, 1979.
Контрольная работа № 2:
«Физическая и коллоидная химия»
| № варианта | Номера задач |
| 1, 11, 21, 31, 41, 51 | |
| 2, 12, 22, 32, 42, 52 | |
| 3, 13, 23, 33, 43, 53 | |
| 4, 14, 24, 34, 44, 54 | |
| 5, 15, 25, 35, 45, 55 | |
| 6, 16, 26, 36, 46, 56 | |
| 7, 17, 27, 37, 47, 57 | |
| 8, 18, 28, 38, 48, 58 | |
| 9, 19, 29, 39, 49, 59 | |
| 10, 20, 30, 40, 50, 60 |
- Химическая термодинамика как наука. Первый закон термодинамики, его формулировка и математическое выражение.
- Что такое термодинамическая система? Гомо- и гетерогенные системы. Открытые, закрытые и изолированные системы. Параметры системы. Понятия об изобарических, изотермических и изохорических процессах.
- Понятие об энтальпии. Закон Гесса и следствия из него.
- Вычислить тепловой эффект реакции
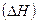 при стандартных условиях
при стандартных условиях 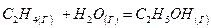
- Вычислить тепловой эффект реакции
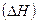 при стандартных условиях
при стандартных условиях 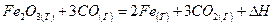
- Вычислить тепловой эффект реакции
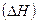 при стандартных условиях
при стандартных условиях 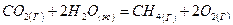
- Термохимические реакции. Определение теплоты реакции по методике Гесса. Калорийность продуктов питания.
- Второй закон термодинамики. Его формулировки и расшифровка на примере работы тепловой машины.
- Вычислить тепловой эффект реакции
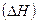 при стандартных условиях
при стандартных условиях 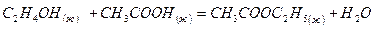
- Вычислить тепловой эффект реакции
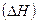 при стандартных условиях
при стандартных условиях 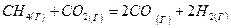
- Уравнения состояния идеального и реального газов. Уравнение Ван-дер-Ваальса.
- Газообразное состояние вещества: уравнение состояния идеального газа.
- Поверхностное натяжение, методы его определения.
- Вязкость жидкости. Способы ее определения.
- Особенности твердого состояния вещества. Анизотропия. Полиморфизм.
- Типы кристаллических решеток.
- В стальном баллоне емкостью 25 л находится кислород под давлением 80 атм при 18оС. Определите массу кислорода.
- В стальном баллоне емкостью 10л находится кислород под давлением 250 атм при 0оС. Какой объем займет кислород при н. у.?
- Масса 500 см3 ацетона при температуре 37оС и давлении 101,3 кПа равна 0,93г. Определить молярную массу ацетона.
- Особенности жидкого состояния.
- Как изменится скорость реакции
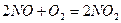 , если уменьшить объем ицентонного сосуда в 3 раза?
, если уменьшить объем ицентонного сосуда в 3 раза? - Скорость химической реакции, факторы на нее влияющие.
- Влияние концентрации на скорость химической реакции. Закон действующих масс.
- Влияние температуры на скорость химических реакций.
- Скорость реакции в гетерогенных системах.
- Катализ и катализаторы.
- Гомогенный катализ.
- Гетерогенный катализ.
- Ферметативный катализ.
- Определите, во сколько раз увеличится скорость реакции
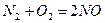 , если увеличить количества веществ азота и кислорода в реакционной системе в два раза при постоянном объеме.
, если увеличить количества веществ азота и кислорода в реакционной системе в два раза при постоянном объеме. - Найдите значение константы скорости реакции A + B = AB, если при ицентрацииях веществ A и B, равных соответственно 0,5 и 0,1 моль/л, скорость реакции равна 0,005 моль/л с.
- Фазовые переходы. Фазовое равновесие.
- Химическое равновесие. Обратимые и необратимые реакции.
- Смещение химического равновесия. Принцип Ле – Шателье.
- Однокомпонентные системы. Фазовые диаграммы однокомпонентных систем.
- В какую сторону сместится химическое равновесие системы
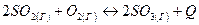
– при повышении температуры;
– при повышении давления;
– при увеличении концентрации оксида серы (VI)? Дайте обоснованный ответ.
- Как повлияет: а) повышение давления; б) повышение температуры; в) увеличение концентрации кислорода на химическое равновесие системы:
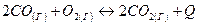
Дайте обоснованный ответ.
- Укажите три условия, которые будут способствовать смещению химического равновесия реакции
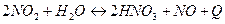 в сторону образования азотной ислоты.
в сторону образования азотной ислоты. - Гидрирование бензола выражается следующим уравнением реакции:
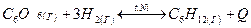
При каких условиях следует проводить гидрирование бензола? В какую сторону сместится химическое равновесие данной реакции при: а) понижение температуры; б) уменьшение давления; в) увеличение концентрации бензола? Ответ обоснуйте.
- Дано уравнение обратимой химической реакции:
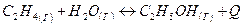
Укажите условия, которые вызывают смещение химического равновесия в сторону реакции образования этилового спирта. Дайте обоснованный ответ.
- Дано уравнение обратимой химической реакции:
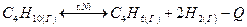
В какую сторону будет смещаться химическое равновесие данной реакции при: а) понижении температуры; б) уменьшении давления; в) уменьшении концентрации водорода? Дайте обоснованный ответ.
- Свойства растворов. Общая характеристика растворов.
- Концентрация растворов.
- Растворы газов в жидкостях.
- Взаимная растворимость жидкостей.
- Диффузия и осмос в растворах.
- Замерзание и кипение растворов.
- Вычислите массу фенолята натрия, если для его получения взяли фенол и 120г. 60% - ного раствора гидроксида натрия.
- Какая масса соли образуется при взаимодействии аминоуксусной кислоты с 250г. 10% - ного раствора серной кислоты?
- Какая масса этилового эфира аминоуксусной кислоты образуется при взаимодействии 150г. 20% - ного раствора аминоуксусной кислоты с этиловым спиртом?
- Какая масса этилата натрия образуется при взаимодействии натрия с 60мл 98% - ного этилового спирта, плотность которого 0,8 г/мл?
- Общая характеристика дисперсных систем. Классификация дисперсных систем.
- Методы получения коллоидных систем.
- Строение коллоидных частиц.
- Общая характеристика микрогетерогенных систем. Суспензии. Эмульсии.
- Общая характеристика микрогетерогенных систем. Пены. Аэрозоли.
- Общие сведения о высокомолекулярных соединениях.
- Свойства растворов высокомолекулярных веществ.
- Гели. Студни.
- Коагуляция дисперсной системы. Скорость коагуляции. Причины, вызывающие процесс самопроизвольной коагуляции.
Перечень вопросов к экзамену:
«Физическая и коллоидная химия»
1. Физическая и коллоидная химия, ее содержание М.В. Ломоносов основоположник физической химии.
2. Предмет термодинамики. Основные понятия термодинамики.
3. Первый закон термодинамики Энтальпия.
4. Термохимия Экзо и Эндотермические реакции, термохимические уравнения.
5. Закон Гесса, следствия из закона Гесса.
6. Решение задачи на расчет теплового эффекта реакции.
7. Второе начало термодинамики
8. Общая характеристика основных агрегатных состояний.
9. Газообразное состояние вещества уравнение состояния идеального газа.
10. Уравнение состояния реального газа.
11. Характеристика жидкого состояния вещества.
13. Методы определения поверхностного натяжения.
14. Вязкость жидкостей
15. Методы определения вязкости жидкости.
16. Характеристика твердого состояние вещества.
17. Характеристика кристаллических решеток.
18. Скорость химической реакции, факторы на нее влияющие.
19. Влияние концентрации на скорость химической реакции
20. Влияние температуры на скорость химической реакции
21. Катализ и катализаторы.
22. Химическое равновесие, смещение химического равновесия.
23. Решение задачи на смещение химического равновесия
24. Общая характеристика растворов.
25. Способы выражения концентрации растворов.
26. Решение задачи на нахождение концентрации растворов.
27. Адсорбция, ее виды
28. Дисперсные системы, классификация
29. Методы, полученные коллоидных систем.
30. Строение коллоидной частицы
32. Характеристика пен.
33. Характеристика аэрозоли.
 2014-02-17
2014-02-17 1836
1836








