Паровой стерилизатор ГПД-280 в от-
личие от стерилизатора ГП-280 снабжен двумя дверцами с централизованными затворами и блокировкой. Встраивается в проем стены, разделяющей асептический блок и стерилизационную комнату. Паровой стерилизатор ГПС-500 питается от централизованного источника пара (котельной).
Подготовка аппаратов к стерилизации должна начинаться с наполнения водой водопаровой камеры через воронку водоуказательной колонки до верхней отметки. При этом должны быть открыты кран, вентиль и крышка стерилизатора. После загрузки стерилизационной камеры крышку стерилизатора закрывают, плотно прижав ее болтами. Вентиль и кран должны быть закрыты. Затем в манометре устанавливают пределы автоматического поддержания давления и включают аппарат в сеть.
Перед началом стерилизации из стерилизатора необходимо полностью удалить воздух. Для этого стерилизатор сначала нагревают с открытым краном. Через 10—15 минут после того, как пар пойдет сильной струей, кран закрывают. Для проверки отсутствия воздуха в стерилизаторе целесообразно трубку от выпускного крана поместить в пробирку с водой, опрокинутую в сосуд, наполненный водой. При выходе из стерилизатора пара без примеси воздуха вода из пробирки вытесняться не будет. Удаление воздуха из стерилизатора крайне необходимо, так как оставшийся в нем воздух резко снижает коэффициент теплопередачи пара (теплопроводность пара, содержащего 5 % воздуха, уменьшается на 50 %), вследствие чего невозможно обеспечить равномерный прогрев стерилизуемых материалов и надежность стерилизации. Установлено, что споры сибирской язвы при стерилизации погибают в разное время в зависимости от количества воздуха, находящегося в паре. Если пар содержит 8 % воздуха, при давлении 0,1 МПа споры погибают в течение 3 минут, при наличии 20 % — за 10 минут, а при содержании 37 % воздуха — через 30 минут.
При нагревании стерилизатора параллельно росту давления повышается температура в стерилизационной камере. Зависимость между температурой и давлением воздуха выражается следующим образом: 0,05 МПа — 110 °С; 0,1 МПа — 119,6 °С; 0,15 МПа — 126,8 °С; 0,2 МПа — 132,9 °С.
Время стерилизации должно отсчитываться с момента установления заданного давления, которое поддерживается при стерилизации автоматически. По истечении времени стерилизации открывают вентиль, соединяющий стерилиза-ционную камеру с атмосферой, выпускают через него пар и конденсат и после того, как стрелка манометра станет на «0», открывают крышку и разгружают стерилизационную камеру.
В последние годы созданы новые паровые стерилизаторы специально для растворов с принудительным охлаждением стерилизуемых объектов: ГП-400 и др.
Стерилизационная камера стерилизатора ГП-400 имеет паровую рубашку и оснащена дверью скользящего типа, а загрузочно-разгрузочное устройство выполнено в виде тележки с подвижно размещенной кареткой, на которой устанавливают кассеты с герметично укупоренными сосудами для крови. После загрузки флаконов дверь стерилизационной камеры герметично закрывается и нажатием кнопок «сеть» и «пуск» последовательно включаются в работу автономная система пароснабжения, система подготовки воздуха и осуществляется процесс стерилизации.
Новые стерилизаторы, предназначенные специально для стерилизации растворов в герметично укупоренной таре, позволяют резко сократить требуемое для этого время за счет принудительного охлаждения. Вторым важным преимуществом вновь созданных стерилизаторов является то, что в конце процесса стерилизации температура жидкости во флаконах не превышает 60—70 °С. Это исключает бой флаконов в стадии разгрузки стерилизатора и гарантирует безопасность для обслуживающего персонала. Кроме того, принудительное охлаждение укорачивает время воздействия повышенной температуры на лекарственное вещество, в результате чего химическая устойчивость лекарств в растворах повышается. Поскольку стерилизаторы — это аппараты, работающие под давлением, за их исправностью следит инспекция котлонадзора. Лица, работающие со стерилизатором, должны хорошо знать его устройство и строго соблюдать правила по технике безопасности. Обслуживание стерилизаторов разрешается только лицам, достигшим 18-летнего возраста, окончившим курсы по обслуживанию автоклавов, прошедшим предварительный медицинский осмотр и инструктаж по безопасному обслуживанию стерилизаторов.
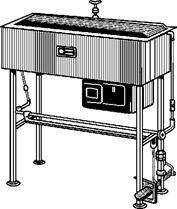
Стерилизация текучим паром осуществляется насыщенным водяным паром температуры 100 °С. Текучий пар находит применение в тех случаях, когда требуется убить только вегетативные формы микроорганизмов. При наличии в объекте споровых форм этот метод неэффективен. Стерилизация текучим паром производится в стерилизаторах, представляющих собой металлические сосуды цилиндрической формы, закрывающиеся крышкой с двумя отверстиями — для термометра и выхода пара. На дно сосуда наливается вода, поверх которой находится металлическая подставка с отверстиями. Иногда аппарат снабжается двойными стенками, и пар, выходя из паровой камеры, направляется в промежуток между ними. Такая конструкция обеспечивает сохранение постоянства температуры при стерилизации. В аптечной практике находят применение стерилизаторы С-60 (рис. 139), ВКО-16, ВК-75.
|
Нагревание текучим паром (по
ГФ X) производят в течение 30—
60 минут. Продолжительность
стерилизации зависит от физико-
химических свойств лекарствен-
ных веществ и объема раствора.
Установлено, что при нагревании
стерилизатора температура ра-
створа во флаконах отстает от
температуры паровой камеры.
Для небольших объемов отстава-
ние невелико (2—3 минуты), а
для объемов более 500 мл — оно
значительно. Поэтому при стери-
лизации растворов более 100 мл
увеличивается продолжитель-
ность стерилизации: Рис. 139. Стерилизатор С-60
до 100 мл — 30 минут; от 101 до 500 мл — 45 минут; от 501 до 1000 мл — 60 минут.
Стерилизация растворов объемом более 1 л запрещается.
Тиндализация — дробная стерилизация, которая заключается в нагревании при температуре 60—65 °С по 1 часу в течение 5 дней или при температуре 70—80 °С в течение 3 дней. Стерилизуемую жидкость хранят в промежутках между нагреваниями при температуре 25—37 °С. Этот метод стерилизации используют для лекарственных веществ и их растворов, которые не выдерживают нагревания при 100 °С. При этом в ходе стерилизации гибнут не только микроорганизмы, но и их споры, которые прорастают в интервалах между нагреваниями. Метод тиндализации в аптечной практике используется редко. Чаще его применяют в заводских условиях при приготовлении ампулированных растворов. Тиндализация по конечному эффекту не уступает автоклавированию, но длительная.
П а с т е р и з а ц и я — однократное нагревание раствора при температуре 80 °С в течение 30 минут. Она дает возможность уничтожить вегетативные формы микроорганизмов, но не споры. Способ недостаточно надежен. ГФ X разрешает пользоваться этим методом при приготовлении растворов термолабильных веществ с добавлением антисептиков (0,5 % фенола или 0,3 % трикрезола). В присутствии антисептика понижается вирулентность и жизнеспособность микробов, приостанавливается рост и размножение микробных клеток. Споры микробов не уничтожаются, но в присутствии антисептиков не прорастают. Действие антисептиков значительно усиливается при повышении температуры раствора.
Пастеризация и тиндализация допускаются только в исключительных случаях в соответствии с указанием частных фармакопейных статей.
Контроль эффективности термических методов стерилизации осуществляется с помощью контрольно-измерительных приборов, химических и биологических тестов.
Бактериологические методы — самые точные и осуществляются с помощью биотеста стерилизации. Биотест стерилизации — объект из установленного материала, обсемененный тест-микроорганизмами, предназначенный для контроля эффективности стерилизации. В качестве биотеста могут быть использованы тест-микроорганизмы: чистые культуры, спорообразующих микроорганизмов типа B. subtilis, B. stearothermophylus и др., нанесенные на стерилизуемый материал.
Химический тест стерилизации основан на свойстве ряда веществ изменять свое физическое состояние или цвет под воздействием определенной температуры.
Обычно пользуются следующими веществами: сера (температура плавления — 111—120 °С), антипирин (110 °С), антифибрин (115 °С), резорцин (110 °С), кислота бензойная (121—122 °С), Р-нафтол (120— 122 °С), мочевина (132 °С), фенацетин (134—135 °С). Для контроля сухожаровой стерилизации используются: тиомочевина (180 °С), кислота янтарная (180—184 °С), барбитал (190—191 °С) и некоторые другие вещества. В последние годы стали применять цветные термоиндикаторы (табл. 32), которые с большой точностью указывают уровень температуры (колебания 1—2 °С).
Таблица 32
Характеристика термоиндикаторов
| Индекс окраски | Температура изменения цвета, °С | Цвет до нагрева | Цвет после нагрева |
| ТП 111 | 111±2 | Белый | Бесцветный |
| ТП 116 | 116±1 | Светло-бирюзовый | Темно-бирюзовый |
| ТП 122 | 122±2 | Светло-розовый | Красный |
| ТП 123 | 123±1 | Светло-голубой | Синий |
| ТП 126 | 126±1 | Светло-голубой | Синий |
| ТП 130 | 130±1 | Светло-салатный | Зеленый |
| ТП 134 | 134±2 | Светло-серый | Сиреневый |
| ТП 145 | 145±2 | Светло-розовый | Малиновый |
| ТП 155 | 155±2 | Абрикосовый | Абрикосовый |
| ТП 160 | 160±1 | Светло-голубой | Бирюзовый |
| ТП 167 | 167±1 | Светло-салатный | Зеленый |
| ТП 179 | 179±2 | Светло-розовый | Красный |
| ТП 182 | 182±2 | Светло-салатный | Зеленый |
| ТП 193 | 193±2 | Бледно-абрикосовый | Оранжевый |
| ТП 212 | 212±1 | Светло-желтый | Желтый |
Стерилизация ультрафиолетовыми лучами. УФ-излучение — мощный стерилизующий фактор, способный убивать вегетативные и споровые формы микроорганизмов. В настоящее время УФ-лучи широко применяют в различных отраслях народного хозяйства для обеззараживания воздуха помещений, воды и др. Применение их в аптеках имеет большое практическое значение и существенные преимущества по сравнению с применением дезинфицирующих веществ, так как последние могут адсорбироваться медикаментами, которые в связи с этим приобретают посторонние запахи.
Ультрафиолетовая радиация — невидимая коротковолновая часть солнечных лучей с длиной волны меньше 300 нм. Предполагают, что УФ-радиация вызывает фотохимическое нарушение ферментных систем микробной клетки, действует на протоплазму клетки с образованием ядовитых органических перекисей и приводит к фото-димеризации тиаминов. Эффективность бактерицидного действия УФ-излучения зависит от ряда факторов: длины волны излучателя, дозы и времени облучения, вида инактивируемых микроорганизмов, запыленности и влажности среды. Наибольшей стерилизующей способностью обладают лучи с длиной волны 254—257 нм. В зависимости от времени воздействия различают стадии стимуляции, угнетения и гибели микробных клеток. Вегетативные клетки более чувствительны к УФ-излучению, чем споры. Для уничтожения спор требуется доза в среднем в 10 раз выше, чем для уничтожения вегетативных клеток. Запыленность и влажность среды значительно снижают эффективность стерилизации УФ-лучами.
В качестве источников УФ-излучения в практике аптек применяются специальные лампы БУВ (бактерицидная увиолевая). Лампа изготовляется в виде прямой трубки из специального увиолевого стекла, с электродами из двойной вольфрамовой спирали, покрытой углекислыми солями бария и стронция. В трубке находятся небольшое количество ртути и инертный газ аргон под давлением в несколько миллиметров ртутного столба. Источником УФ-излучения является разряд в парах ртути, происходящий между электродами при подаче на них напряжения. В состав увиолевого стекла входит до 72 % оксидов кремния, алюминия, бария. По сравнению с обычным стеклом оно содержит небольшое количество натрия оксида. Коэффициент пропускания УФ-лучей для увиолевого стекла 75 %. Указанные лампы обладают сильным бактерицидным свойством, так как максимум излучения близок к максимуму бактерицидного действия (254 нм). В то же время образование озона и оксидов азота незначительно, поскольку на долю волн, образующих эти продукты, приходится 0,5 %. Промышленностью выпускаются лампы БУВ-15,
БУВ-30, БУВ-60 и др. (табл. 33).
Таблица 33
Технические характеристики облучателей
| Количество ламп | Потребляе- | ||||
| Облучатель | Марка | Тип ламп | |||
| экранированных | открытых | мая мощность, Вт | |||
| Бактерицидный на штативе | ОБН-200 | — | БУВ-30 | ||
| Бактерицидный передвижной | ОБПЕ-450 | — | БУВ-30 | ||
| Бактерицидный потолочный | ОБП-300 | БУВ-30 | |||
| Бактерицидный потолочный | ОБП-350 | БУВ-15 БУВ-30П | |||
| Бактерицидный настольный | ОБН-150 | БУВ-30 | |||
| Бактерицидный настенный | ОБН-200 | БУВ-30П |
В настоящее время УФ-лампы широко применяются в аптеках для стерилизации воздуха, воды очищенной при подаче ее по трубопроводу, вспомогательных материалов и т. д. Для стерилизации воздуха целесообразно использовать настенные и потолочные бактерицидные облучатели, подвешивая их на высоте 1,8—2 м от пола и размещая по ходу конвекционных потоков воздуха равномерно по всему помещению. В отсутствии людей стерилизацию можно проводить неэкранированными лампами из расчета мощности 3 Вт на 1 м3 помещения. Время стерилизации 1—1/2 часа. Удобно пользоваться экранированными лампами, свет которых направлен вверх, таким образом УФ-лучи не оказывают действия на глаза и кожные покровы. Наличие экранированных ламп позволяет обеззараживать воздух в присутствии работающих. В этом случае число ламп определяется из расчета мощности 1 Вт на 1 м3 помещения.
Для стерилизации воздуха в аптеках предложены передвижные бактерицидные облучатели большой мощности, состоящие из 6 ламп БУВ-30 и обеспечивающие большую скорость стерилизации. Использование этого аппарата в помещении объемом до 100 м3 позволяет в течение 15 минут снизить обсемененность воздуха на 90—96 %. Другой тип бактерицидного облучателя оснащен лампой БУВ-30П и соответствующим отражателем, позволяющим направлять лучи. Он предназначен для стерилизации помещения объемом до 20 м3.
При стерилизации воздуха УФ-излучением необходимо соблюдать определенные правила, чтобы избежать нежелательного воздействия УФ-лучей на организм человека. При неумелом пользовании может произойти ожог конъюнктивы глаз и кожи, поэтому категорически запрещается смотреть на включенную лампу. При приготовлении лекарств в поле УФ-излучения надо защищать руки 2 %-ным раствором или 2 % мазью новокаина или парааминобензойной кислоты. Необходимо также систематически проветривать помещение для удаления образующихся окислов азота и озона.
Время облучения воздуха лампами БУВ может быть значительно уменьшено, если до санации добавить в воздух аэрозоль триэтилен-гликоля или других подобных ему веществ.
При стерилизации воздуха УФ-лучами необходимо учитывать возможность многочисленных фотохимических реакций лекарственных веществ при поглощении излучения. Поэтому все медикаменты, находящиеся в помещении для приготовления лекарств, требующих асептики, целесообразно хранить в таре, не пропускающей УФ-лучи (стекло, полистирол, окрашенный полиэтилен и др.).
Ультрафиолетовое излучение используется для стерилизации воды очищенной. Для этого применяются аппараты с погруженными и непогруженными источниками УФ-излучения. В аппаратах первого типа бактерицидная лампа, покрытая кожухом из кварцевого стекла, помещается внутри водопровода и омывается водой. В аппаратах с непогруженными лампами они помещаются над поверхностью облучаемой воды. В связи с тем, что обычное стекло практически непроницаемо для УФ-лучей, водопровод в местах облучения делается из кварцевого стекла.
Лампы УФ-излучения можно использовать для обеззараживания поступающих в аптеку рецептов, являющихся одним из основных источников микробного загрязнения воздуха и рук ассистента. Представляет интерес аппарат для обеззараживания рецептов, в основе которого лежит принцип облучения их шестью бактерицидными лампами БУВ-30 с двух сторон. Производительность аппарата до 180 рецептов в час.
Ультрафиолетовое излучение можно применять для стерилизации вспомогательных материалов и аптечного инвентаря.
Радиационная стерилизация — высокоэффективный и перспективный метод стерилизации, который в последние годы получает все более широкое распространение для стерилизации медицинской продукции. Изучается возможность радиационной стерилизации лекарственных средств (солевые инфузионные растворы, лечебные глазные пленки и др.). Бактерицидный эффект ионизирующего излучения проявляется в результате воздействия на метаболические процессы в клетке. Чувствительность микроорганизмов к ионизирующему излучению зависит от многих факторов: наличия влаги, кислорода, рН среды, температуры и др.
Для лучевой стерилизации используют гамма-излучение от изотопов 60Со и 137Со, а также быстрые электроны от линейных ускорителей, антимикробное действие которых одинаково. Стерилизационная доза составляет 2,5 мрад, но возможны и другие дозы в зависимости от конкретных условий на производстве.
Основные достоинства метода: высокая степень инактивации микроорганизмов, эффективность при низкой температуре, возможность автоматизации процесса, стерилизация изделий в упаковке.
В настоящее время имеется большой ассортимент изделий медицинского назначения, которые могут быть простерилизованы этим методом: гигроскопическая вата, перевязочный материал, изделия из пластмасс, части к различным аппаратам и приборам, биологические и бактериальные препараты, антибиотики.
Стерилизация токами высокой частоты. Токами высокой частоты называются токи, образующие электромагнитное поле, которое меняется с высокой частотой, вызывает изменение ориентации молекул и поглощение части энергии поля веществом. В результате происходит быстрый нагрев вещества и его стерилизация.
Механические методы стерилизации. Для растворов лекарственных веществ, чувствительных к тепловым и радиационным воздействиям, может быть использован метод стерилизации фильтрованием через мелкопористые фильтры. В отличие от других способов стерилизации, при которых микроорганизмы только теряют жизнеспособность, при стерилизующем фильтровании они полностью удаляются из раствора, тем самым обеспечивая его стерильность и апи-рогенность. Метод стерилизации фильтрованием — разновидность фильтрования растворов (микрофильтрация). При стерилизующем фильтровании более тонкая очистка достигается использованием соответствующих фильтрующих сред в виде глубинных и мембранных фильтров.
Глубинные фильтры характеризуются сорбционным и инерционным механизмами удержания частиц. Большая толщина этих фильтров приводит к тому, что они удерживают частицы меньшего размера, чем размер пор фильтра. Так, фильтры с максимальным диаметром пор 1,6 мкм при определенных условиях стерилизующие. В связи с этим в глубинных фильтрах за размер пор обычно принимают величину наименьших частиц, удерживаемых данным фильтром в количестве 100 %. Однако, обладая высокой способностью задерживать загрязнения из фильтруемых растворов, глубинные фильтры имеют и ряд недостатков. Размер пор этих фильтров значительно больше величины улавливаемых частиц, поэтому в процессе фильтрования должны строго соблюдаться все необходимые условия (рН среды, давление, температура и др.). При длительном фильтровании возможно прорастание микроорганизмов, задержанных матрицей, и попадание их в фильтрат. Помимо этого, большая часть глубинных фильтров состоит из волокнистых материалов, в связи с чем возникает угроза отрыва незакрепленных волокон и загрязнение фильтрата. Попадая в организм, эти волокна могут вызывать различные патологические реакции.
Получившие в последние годы большое распространение для стерилизующего фильтрования микропористые мембранные фильтры лишены этих недостатков. Мембранные фильтры представляют собой тонкие (100—150 мкм) пластины из полимерного материала, характеризующиеся ситовым механизмом задержания и постоянным размером пор. Принято считать, что средний размер пор фильтра, гарантирующего получение стерильного фильтрата, составляет 0,3 мкм. Во избежание быстрого засорения мембраны используют в сочетании с предфильтрами, имеющими более крупные поры. При стерилизации больших объемов растворов рационально применение фильтров обоих типов.
За рубежом для фармацевтических целей производится около десяти типов мембранных фильтров (Миллипор, Сарториус, Синпор, Дюрапор и др.). В Казани выпускаются мембранные фильтры «Вла-дипор» из ацетата целлюлозы типа МФА, из регенерированной целлюлозы типа МФЦ, которые могут быть использованы для очистки от механических примесей и микроорганизмов растворов лекарственных веществ, имеющих рН в пределах 1,0—10,0. Фильтры «Влади-пор» выпускаются 10 номеров в диапазоне размеров пор от 0,05 до 0,95 мкм и более.
Для стерилизации растворов лекарственных веществ предназначены фильтры МФА-3 и МФА-4 со средним размером пор соответственно 0,25—0,35 и 0,35—0,45 мкм. Выпускаются они в виде пластин и дисков разного диаметра. Фильтры типа МФА могут быть простерилизованы насыщенным водяным паром под давлением при температуре 120 °С, сухим горячим воздухом при 180 °С, обработкой формальдегидом, этиловым спиртом, водорода пероксидом, этилена оксидом, УФ- или гамма-лучами.
Перспективны также полимерные пленки с цилиндрическими порами — так называемые ядерные фильтры; фильтры «Мифил» из полиамидкапрона ПА-6 с диаметром пор 0,2 мкм.
Стерилизующее фильтрование осуществляют в установках, основными частями которых являются фильтр-держатель и фильтрующая среда. Используют два типа держателей — пластинчатые, в которых фильтр имеет форму круглой или прямоугольной пластины, и патроны, содержащие один трубчатый фильтр или больше. Перед фильтрованием производят стерилизацию фильтра в держателе и емкости для сбора фильтрата насыщенным водяным паром при 120 °С или горячим воздухом при 180 °С.
Метод мембранной (или стерильной) фильтрации целесообразно использовать для растворов термолабильных веществ, например, глазные капли «Пропомикс» (выпускаются МП «Апитек»). С этой целью успешно применяется установка фильтрационная (УФ), которая производится в г. Кириши. Производительность УФ при рабочем давлении 0,3 Мпа (3 кгс/см2) на мембране «Владипор» МФА-А № 2 с филь-
тродержателем ФД-142 — 0,08 м3/ч (80 л/ч) и ФД-293 — 0,2 м3/ч
(200 л/ч). Перед началом и в конце фильтрования раствора проводят испытание установки на герметичность и целостность мембранного фильтра.
Использование стерилизации фильтрованием имеет смысл только в том случае, если сам разлив раствора во флаконы осуществляется в строго асептических условиях с использованием оборудования с ламинарным потоком воздуха.
Контроль стерилизации этим методом проверяют прямым посевом проб фильтрата на питательные среды.
Химические методы стерилизации. Для изделий из резины, полимерных материалов, стекла, коррозиестойких металлов в настоящее время применяют химические методы стерилизации газами и растворами. Для газовой стерилизации используют этилена оксид чистый или с различными флегматизаторами (бромистый метил, углерода диоксид, фреоны и др.). Стерилизацию осуществляют в газовых стерилизаторах. Эффективность стерилизации этим методом зависит от дозы стерилизующего агента, температуры, относительной влажности воздуха.
Стерилизуемые объекты предварительно упаковывают в пакеты из полиэтиленовой пленки или пергаментную бумагу. Изделия, про-стерилизованные газовым методом, выдерживают в вентилируемом помещении в течение одних или нескольких суток в зависимости от вида изделий и их назначения.
Стерилизацию газами можно также применять и для стерилизации воздуха в боксах, вспомогательных материалов (особенно термолабильных), посуды, пробок; перевязочного материала, предметов ухода за больными и т. д. Газы легко проникают через упаковочные материалы (бумагу, целлофан, полиэтилен), а после стерилизации легко улетучиваются. Необходимо помнить об их ядовитости, раздражающем действии и при работе с ними соблюдать меры защиты (специальная одежда, маски и др.).
В зарубежных странах широкое применение для стерилизации воздуха находят аэрозольные препараты, представляющие собой жидкие физико-химические системы, приготовленные на сжиженных газах (фтортрихлорметан, трифтортрихлорэтан, углерода диоксид и др.). Аэрозоли могут находиться длительное время в воздухе, оказывая дезинфицирующее действие. Для стерилизации воздуха используют аэрозоли этиленгликоля и полиэтиленгликолей. Наиболее эффективным считают аэрозоль триэтиленгликоля, при распылении которого полная стерильность воздуха в помещении достигается за несколько минут.
Изучается также использование газовой стерилизации для лекарственных веществ и растворов (атропина сульфата, промедола, кордиамина, кофеин-бензоата натрия и др.). В этом случае необходимо прежде всего выяснить возможность взаимодействия газов с лекарственными веществами. В зарубежной литературе имеются сообщения о возможности стерилизации газами антибиотиков, панкреатина и некоторых других веществ.
Для стерилизации растворов можно применять Р-пропилолактон, который представляет собой жидкость, кипящую при 153 °С. Растворяясь в воде, он гидролизуется до Р-оксипропионовой кислоты. Р-пропилолактон применяют в концентрации 0,2 % по объему и инкубируют при 37 °С в течение 2 секунд.
Для химической стерилизации растворами используют 6 % -ный раствор водорода пероксида и надкислоты (дезоксон-1). Стерилизацию производят в закрытых емкостях из стекла, пластмассы или покрытых эмалью. Эффективность стерилизации этим методом зависит от концентрации стерилизующего агента, времени стерилизации и температуры стерилизующегося раствора. При химической стерилизации изделие полностью погружают в раствор, выдерживают в нем определенное время, а затем промывают стерильной водой в асептических условиях.
Одной из разновидностей химической стерилизации является консервирование лекарственных форм, то есть предохранение лекарственных препаратов от микробной порчи в процессе их использования путем добавления к ним различных химических веществ.
К консервантам предъявляется ряд требований: фармакологическая индифферентность в используемой концентрации (отсутствие общетоксического и местнораздражающего действия); широкий антимикробный спектр; отсутствие химического взаимодействия с лекарственными веществами и другими компонентами лекарственных препаратов; отсутствие влияния на органолептические свойства лекарств; устойчивость при хранении; поддержание стерильности лекарственных форм в течение всего времени их применения, то есть надежная антимикробная активность.
Консервирующие вещества применяются только в крайне необходимых случаях, когда нельзя писпользовать стерилизацию или другие приемы для сохранения стерильности из-за сложной физико-химической структуры лекарственных препаратов или из-за невозможности создания упаковок с одноразовыми дозами. Консерванты применяют также для сохранения стерильности при многократном использовании. Проблема консервирования лекарственных препаратов особенно важна для стерильных и асептически приготовляемых лекарственных форм. Поэтому характеристика консервантов представлена в данной главе (эти вещества могут также применяться в технологии водных извлечений, эмульсий, мазей, приготовленных на гидрофильных и эмульсионных основах, и др.). Консервирующие вещества прибавляются к растворам для инъекций, содержащих вещества, разлагающиеся при нагревании. Консерванты должны быть указаны в рецепте или в частных статьях. Их наименование и количество пишется в ППК.
Лекарственные средства для внутриполостных, внутрисердечных, внутриглазных и инъекций, имеющих доступ к спинномозговой жидкости, а также при разовой дозе, превышающей 15 мл, не должны содержать консервантов.
 2014-02-17
2014-02-17 380
380








