Кислородный баланс. Кислородным балансом называется отношение избытка или недостатка кислорода в составе ВВ, необходимого для полного окисления всех горючих элементов (водорода, углерода, металлов и т.п.), к массе данного ВВ. Кислородный баланс измеряется в долях единиц или процентах.
Под полным окислением в процессе взрывчатого превращения ВВ понимается окисление водорода до получения воды, а углерода - до получения углекислого газа. При этом выделяются молекулярный азот и кислород. Если в составе ВВ находится металл, то образуется его высший окисел. Реакции полного окисления имеют следующий вид:
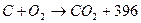 кДж/моль,
кДж/моль,
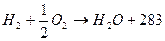 кДж/моль - при воде жидкой,
кДж/моль - при воде жидкой,
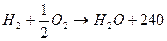 кДж/моль - при воде парообразной,
кДж/моль - при воде парообразной,
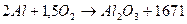 кДж/моль.
кДж/моль.
Следовательно, если ВВ имеет состав в виде CaHbNcOd, то кислородный баланс рассчитываем по формуле, %,
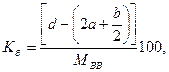 (1.1)
(1.1)
где a, b, d - количество атомов углерода, водорода, кислорода; 16- относительная атомная масса кислорода; Мвв - молекулярная масса ВВ.
При d > 2а + 0,5b имеем положительный кислородный баланс; при d = 2а + 0,5b - нулевой кислородный баланс; при d < 2а + 0,5b - отрицательный кислородный баланс.
ВВ с нулевым кислородным балансом выделяют максимальное количество энергии и минимальное количество ядовитых газов.
ВВ с отрицательным кислородным балансом образуют при взрыве ядовитую окись углерода (угарный газ) или выделяют чистый углерод в виде сажи. При выделении чистого углерода резко снижается образование газов. Кроме того, недостаток водорода для полного окисления кислорода и полного окисления углерода уменьшает выделение тепла.
При положительном кислородном балансе ВВ выделение энергии уменьшается, так как образуется ядовитая окись азота, поглощающая тепло по реакции
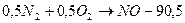 кДж/моль.
кДж/моль.
В случае, когда ВВ представлено смесью нескольких химических веществ, кислородный баланс определяется по формуле
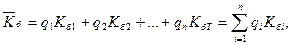 (1.2)
(1.2)
где Кб - кислородный баланс ВВ, представленного смесью нескольких химических веществ, %; i = {1,..., n} - индексы химических веществ, входящих в состав ВВ; qi - весовая доля i-ro химического вещества в составе ВВ, доли ед.; Kбi - кислородный баланс i-ro химического вещества, %.
Рассмотрим примеры расчетов кислородного баланса для однокомпонентного ВВ и для ВВ, представленного смесью химических веществ.
Примечание. Обычно состав промышленных ВВ подбирается с нулевым кислородным балансом. При изготовлении патронированных ВВ принимается небольшой положительный кислородный баланс для окисления материала оболочки патронов. ВВ, предназначенные для подземных работ, не должны образовывать ядовитых газов более 40 л в пересчете на условную окись углерода при взрыве 1 кг. Если образуются окислы азота и сернистый газ, то для перевода их в условную окись углерода принимаются поправочные коэффициенты, соответственно, 6,5 и 2,5.
Пример 1. Определить кислородный баланс тротила C7H5(N02)3, относительная молекулярная масса которого равна 227.
Решение. Для полного окисления необходимо 2а + b/2, или 2∙7 + 5/2 = 16,5 атомов кислорода.
В наличии имеется 6 атомов кислорода. Следовательно,
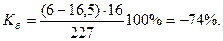
Пример 2. Определить кислородный баланс граммонита 30/70, если известно, что граммонит 30/70 состоит из 30 % аммиачной селитры (NH4NO3) и 70 % тротила С7Н5N3O6.
Решение. Кислородный баланс аммиачной селитры (АС), определенный вышеуказанным способом, равен +20 %, кислородный баланс тротила равен - 74 % (пример 1). Определим кислородный баланс граммонита 30/70:
0,3∙20 + 0,7∙ (-74) = -45,8 %.
Требования к кислородному балансу ВВ для открытых горных работ, особенно применяемым в обводненных условиях, не столь жестки.
Порядок определения рецептуры смесевых ВВ и их химической формулы приведен в примерах 3-5.
Пример 3. Составить рецептуру игданита с нулевым кислородным балансом на основе аммиачной селитры и дизельного топлива (ДТ) с кислородным балансом -320 %.
Решение. Определим количество весовых частей аммиачной селитры для окисления одной части дизельного топлива:
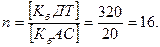
Рассчитаем содержание дизельного топлива во взрывчатом веществе:
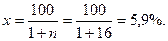
Соответственно, содержание аммиачной селитры
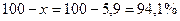
Следовательно, формула игданита будет иметь вид
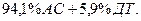
Пример 4. Определить рецептуру и химическую формулу ВВ с нулевым кислородным балансом на основе аммиачной селитры и тротила C7H5(NО2)3.
Решение. Кислородный баланс тротила составляет -74 % при относительной молекулярной массе 227. Кислородный баланс аммиачной селитры равен +20 %, а ее относительная молекулярная масса равна 80. Состав смеси должен отвечать следующему условию:
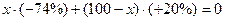 ,
,
где х - содержание в смеси тротила, %; (100 - х) - содержание в смеси аммиачной селитры, %. Значит,
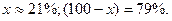
Такому составу смеси отвечают граммонит 79/21 и аммонит 6ЖВ. Обозначим число молей аммиачной селитры через у, число молей тротила через z. Тогда из соотношения
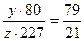
получим
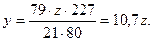
Приняв z = 1, найдем, что у = 10,7. Следовательно, молекулярное уравнение граммонита имеет вид
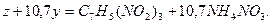
Пример 5. Определить молекулярную формулу гранулита АС-8, имеющего следующий состав: 89 % аммиачной селитры NH4N03; 3 % солярового масла C16H34 (относительная молекулярная масса 226); 8 % алюминиевой пудры А1 (относительная молекулярная масса - 27).
Решение. Обозначив число молей солярового масла через х, аммиачной селитры - через у, алюминиевой пудры - через z, напишем химическую формулу
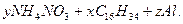
В соответствии с весовым составом вычислим искомые величины по соотношениям
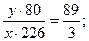
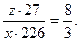
Таким образом, у = 83,9х; z = 22,4х.
Примем х = 1, тогда молекулярное уравнение гранулита АС-8 примет вид
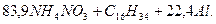
 2014-02-17
2014-02-17 639
639








