Для ферментов характерны все свойства белков + специфические функции:
- зависимость активности Ф от температуры. Температура, при которой каталитическая активность фермента максимальна – температурный оптимум фермента. Для Ф животного происхождения – 40-50 оС. При высоких значениях происходит денатурация белковой молекулы;
- зависимость активности Ф от рН среды. У большинства Ф максимальная активность при нейтральном значении рН. Пепсин желудка – рН 1.5-2.5. Ферменты кишечника – рН более 7. Изменение рН среды может привести к изменению третичной структуры Ф. (скажется на его активности) и изменению свойств субстрата (скажется на формировании фермент-субстратного комплекса);
- специфичность действия ферментов. Одно из основных свойств ферментов. Это избирательность Ф по отношению к одному субстрату или группе субстратов. По теории Э.Фишера (1894) специфичность объяснялась тем, что субстрат точно соответствует структуре субстратного центра как ключ и замок, т.е. активный центр фермента – это слепок субстрата. Однако эта гипотеза не смогла объяснить факт групповой специфичности, когда один Ф катализирует превращение нескольких субстратов. В 50-е гг. 20 века Д. Кошланд предложил теорию «вынужденного соответствия»: молекула Ф не жесткая, а гибкая и эластичная. Конформация субстратного центра изменяется при присоединении субстрата или других веществ. В момент присоединения субстрат «вынуждает» субстратный центр принять нужную форму – как перчатка и рука.
Различают 3 типа субстратной специфичности:
- стереохимическая субстратная специфичность - способность фермента катализировать превращения определенных стереоизомеров. Например, фермент оксидаза L-аминокислот способен окислять все аминокислоты, относящиеся к L-ряду;
- а бсолютная субстратная специфичность - способность фермента катализировать превращение только одного, строго определенного субстрата. Например: уреаза гидролизует только мочевину; г рупповая субстратная специфичность - способность фермента катализировать превращения группы субстратов, сходной химической структуры. Например, алькогольдегидрогеназа катализирует превращение этанола и других алифатических спиртов, но с разной скоростью.
Специфичность действия - это способность фермента катализировать только определенный тип химической реакции. В соответствии со специфичностью действия все ферменты делятся на 6 классов.
Номенклатура и классификация ферментов
В настоящее время известны 2 номенклатуры ферментов: 1) Тривиальная номенклатура (пепсин, трипсин), 2) Рациональнаяноменклатура (берётся корень из названия субстрата + окончание “ аза “; липид – липаза, протеин – протеаза). Известно более 2000 ферментов. Они разделены на 6 классов по типу катализирующей реакции. Классы делятся на подклассы (указывает на химическую природу субстрата), подподклассы (уточняет природу атакуемой связи субстрата или природу акцептора).
Для каждого фермента существует шифр, состоящий из 4 кодовых чисел, разделенных точками. Первая цифра указывает на номер класса фермента, вторая цифра означает подкласс, третья цифра означает подподкласс, четвёртая цифра обозначает порядковый номер фермента в данном подподклассе. Например, лактатдегидрогеназа – КФ 1.1.1.27
1) Оксидоредуктазы: катализируют окислительно-восстановитель-ные реакции. При окислении может происходить либо отнятие водорода от окисляемого вещества, либо присоединение кислорода к окисляемому веществу.
Оксидазы: катализируют перенос протонов и электронов на кислород либо внедряют в молекулу субстрата атом О2.. Монооксидазы - включают один атом О2 в окисляемое вещество. Диоксидазы - включают 2 атома кислорода в окисляемое вещество. Часто c разрывом циклической структуры. По месту разрыва связи присоединяются атомы О2.
Дегидрогеназы: катализируют процесс отщепления атомов Н2. Являются холоферментами, коферментами которых являются никотинамидадениндинуклеотид (НАД), никотинамидадениндинуклеотидфосфат (НАДФ), флавинмононуклеотид (ФМН), флавинадениндинуклеотид (ФАД).
2) Трансферазы: катализируют реакции переноса химических групп с молекулы одного вещества на молекулу другого вещества. В зависимости от переносимых групп выделяют фосфотрансферазы (переносят остаток фосфорной кислоты – образуются фосфорные эфиры с повышенной реакционной способностью), гликозилтрансферазы (перенос гликозильных остатков, участвуют в реакциях синтеза и распада олиго- и полисахаридов), аминотрансферазы (перенос аминогрупп), ацилтрансферазы (перенос ацилов – радикалов карбоновых кислот) на спирты, амины и АК).
3) Гидролазы: катализируют расщепление внутримолекулярных связей при участии молекулы воды. Являются простыми однокомпонентными Ф. К ним относятся эстеразы (гидролиз сложноэфирных связей – липаза, фосфотаза), гликозидазы (гидролиз гликозидных связей углеводов - мальтаза), пептид-гидролазы (гидролиз пептидных связей), амидазы (гидролиз амидов дикарбоновых АК аспарагина и глутамина - аспарагиназа).
4) Лиазы: участвуют в расщеплении или синтезе С-С, С-N, С-О связей не гидролитическим путём. Обеспечивают отщепление или присоединение СО, Н2О, NH3.
5) Изомераза: катализируют реакции изомеризации.
6) Лигазы (синтетазы): ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием энергии АТФ.
Ингибиторы и активаторы ферментов
Активаторы – повышают активность Ф (катионы металлов и некоторые анионы: Mg2+, Mn2+, Zn2+, K+, Co2+, CI-.) Они облегчают образование фермент-субстратного комплекса, присоединение апофермента к коферменту, присоединяются к аллостерическому центру и изменяют его третичную структуру, что приводит к выгодному изменению конформации каталитического и субстратного центров. Ингибиторы – замедляют ферментативные реакции, тормозят действие ферментов. Например, некоторые вещества, похожие на субстрат, могут связываться с субстратным центром фермента и блокировать его работу – это обратимые ингибиторы (связаны с ферментом слабыми типами связей). Выйти из этой ситуации можно увеличением концентрации субстрата, который вытолкнет из субстратного центра ингибитор и займет его место.
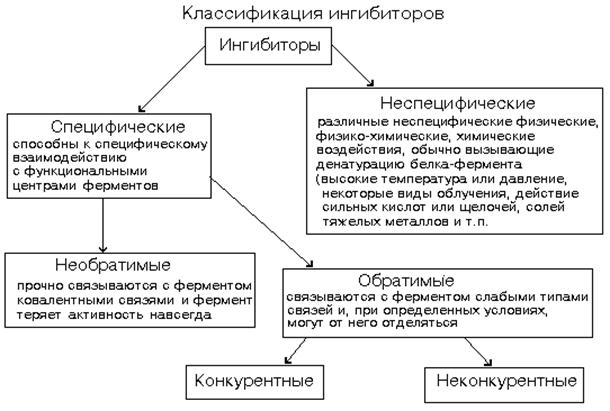
Конкурентные ингибиторы конкурируют с субстратом за обладание активным центром фермента. По структуре они похожи на субстрат. Присоединяются к адсорбционному центру фермента: действуют на стадии I-го этапа ферментативного катализа. Поэтому конкурентные ингибиторы увеличивают Km и уменьшают сродство фермента к субстрату. Они не изменяют Vmax ферментативной реакции: при повышении концентрации субстрата действие конкурентных ингибиторов можно преодолеть - молекулы конкурентного ингибитора постепенно вытесняются субстратом с активного центра фермента. Неконкурентные (аллостерические) ингибиторы с вязываются с аллостерическим центром фермента. Происходят изменения конформации аллостерического центра, а затем, через всю молекулу, они передаются на каталитический центр. Изменение конформации каталитического центра вызывает снижение активности фермента. Поэтому неконкурентные ингибиторы уменьшают Vmax - снижают скорость протекания II-го этапа ферментативного катализа. Не влияют на Km и не изменяют сродство фермента к субстрату.
1. СУБСТРАТ или ПРОДУКТ - аллостерический ИНГИБИТОР своего фермента. При чрезмерном поступлении субстрата в клетку скорость утилизации субстрата все больше будет замедляться. Так происходит, когда избыток продукта реакции опасен для клетки (опаснее, чем избыток субстрата).
2. СУБСТРАТ - аллостерический АКТИВАТОР своего фермента. В этом случае концентрация субстрата удерживается более эффективно на постоянном уровне и в более узком диапазоне, чем в предыдущем случае.
3. ПРОДУКТ реакции - аллостерический АКТИВАТОР своего фермента. С увеличением концентрации субстрата скорость реакции, как обычно, возрастает. Это приводит к накоплению продукта, который активирует фермент, в результате продукт накапливается еще быстрее, а фермент активируется еще сильнее. Скорость реакции становится очень большой, и реакция протекает мгновенно до полного расщепления субстрата.
Автономная саморегуляция ферментативных процессов - это регуляция, которая происходит только за счет фермента, его субстрата (или субстратов) и/или продуктов деятельности данного фермента. Фермент не только работает, но еще и сам себя регулирует. Механизмы автономной саморегуляции очень многочисленны, но построены на двух основных принципах: на кинетических свойствах фермента, количественно характеризуемых Км и Vmax - это механизмы КИНЕТИЧЕСКОГО ТИПА; на аллостерических свойствах фермента, то есть со способностью фермента угнетаться или активироваться под действием субстрата и/или продуктов. Это механизмы АЛЛОСТЕРИЧЕСКОГО ТИПА. Такие аллостерические механизмы есть не у каждого фермента. Они обычно накладываются на механизмы кинетического типа и определяют особенности регуляции данного фермента.
3 уровня регуляции:
- самый молодой уровень филогенетически - НЕЙРОГУМОРАЛЬНАЯ регуляция (с участием центральной нервной системы, классических гормонов и гормонов местного действия);
- РЕГУЛЯЦИЯ НА ГЕНЕТИЧЕСКОМ УРОВНЕ - изменение скорости биосинтеза белка;
- филогенетически наиболее старый уровень - АВТОНОМНАЯ САМОРЕГУЛЯЦИЯ ФЕРМЕНТОВ.
 2014-02-17
2014-02-17 2248
2248
