С начала XX века начинается современный период в истории химии.
Делимость «неделимого». Основной экспериментальной предпосылкой установления делимости атома стали исследования электрического тока. В 1874 г. ирландский физик Джордж Джонстон Стоуни (1826-1911) высказал идею о том, что электричество состоит из элементарных зарядов, связанных с атомами, и вычислил величину этого элементарного заряда; в 1891 г. Стоуни предложил для него термин электрон.
В 1897 г. физики Джон Томсон и Эмиль Вихерт (1861-1928) независимо друг от друга определили отношение заряда электрона к его массе, окончательно доказав его существование
В 1896 г. Антуан Анри Беккерель (1852-1908) изучая флюоресценцию солей урана, случайно открыл радиоактивность. Исследования радиоактивности в корне изменили классическое понятие атома; стало очевидным, что атом надлежит понимать как сложную систему, в образовании которой участвуют некие более простые корпускулы.
К началу 20-х годов XX века изменилось само понятие химического элемента, берущее начало от Бойля. Вместо элемента как химически неразложимого вещества, состоящего из тождественных неделимых атомов, возникло представление об элементе как о совокупности атомов с одинаковым зарядом ядра.
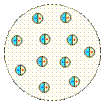
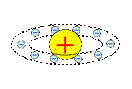
Модели строения атома. Первые модели строения атома появились в самом начале XX века. Жан Перрен в 1901 г. высказал предположение о ядерно-планетарном устройстве атома. Подобную же модель предложил в 1904 г. японский физик Хантаро Нагаока (1865-1950). Однако более широкое распространение получила т.н. кексовая модель атома: в 1902 г. У. Томсон (лорд Кельвин) высказал предположение о том, что атом представляет собой сгусток положительно заряженной материи, внутри которого равномерно распределены электроны. Детально данную модель разработал Дж. Томсон, считавший, что электроны внутри положительно заряженного шара расположены в одной плоскости и образуют концентрические кольца. Немецкий физик Филипп Ленард (1862-1947) создал модель, не предполагающую раздельного существования в атоме противоположных зарядов.
Все упомянутые модели – Томсона – Томсона, Перрена – Нагаоки и Ленарда – являлись сугубо гипотетическими и исключительно качественными.
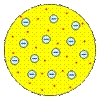
Модель У. Томсона. 1902 г.
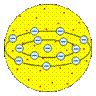
Модель Дж. Томсона. 1904 г.
Модель Ф. Ленарда. 1904 г.
Модель Х. Нагаоки. 1904 г.
Основываясь на экспериментальных данных, Резерфорд в 1911 г. предложил свою ядерную модель атома: в центре атома находится положительно заряженное ядро, объём которого ничтожно мал по сравнению с размерами атома; вокруг ядра вращаются электроны, число которых приблизительно равно половине атомной массы элемента. Несмотря на минусы его модели, она послужила основой для создания принципиально новой теории, которую предложил в 1913 г. датский физик Нильс Хенрик Давид Бор (1885-1962).
 2014-02-17
2014-02-17 1102
1102







