Отношение количества теплоты δQ, полученного телом при бесконечно малом изменении его состояния к связанному с этим изменение температуры тела dТ называется теплоёмкостью тела в данном процессе: С= δQ/ dТ.
Обычно теплоёмкость относят к единице количества вещества и в зависимости от выбранной единицы различают:
- удельную массовую теплоёмкость с, отнесённую к количеству 1кг газа, Dж/кг·К;
- удельную объемную теплоёмкость с/, отнесенную к количеству газа, содержащегося в 1м3 объема при нормальных физических условиях Dж/(м3·К);
- удельную мольную теплоёмкость μc, отнесенную к одному киломолю, Dж/(кмоль·К).
Зависимость между удельными теплоёмкостями устанавливается соотношениями:
с=μ.с/ μ; с/=с.ρн (19)
μ - молекулярная масса компонента, ρн -плотность газа при нормальных условиях.
Изменение температуры тела при одном и том же количестве сообщаемой теплоты зависит от характера происходящего при этом процесса, поэтому теплота является функцией процесса.
В термодинамических расчётах большое значение имеют:
теплоёмкость при постоянном давлении:
ср=δq р/dТ, (20)
равная отношению количества теплоты δq р, сообщённой телу в процессе при постоянном давлении, к изменению температуры тела dТ;
теплоёмкость при постоянном объеме:
сυ= δqυ/ dТ (21)
равная отношению количества теплоты δqυ , подведенной к телу в процессе при постоянном объеме, к изменению температуры тела dТ.
Связь между теплоемкостями ср и сv:
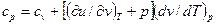 (22)
(22)
Для идеального газа оно значительно упрощается. Действительно, внутренняя энергия идеального газа определяется только его температурой и не зависит от объема, поэтому (∂u/∂v)Т = 0 и, кроме того, из уравнения состояния (3) следует р (∂v/∂Т)р = R, откуда
ср = сv + R (23)
Соотношение (23) называется уравнением Майера и является одним из основных в технической термодинамике идеальных газов.
Теплоемкость реального газа зависит от давления, правда очень слабо.
Поскольку теплоемкость реального газа зависит от температуры, в термодинамике различают истинную и среднюю теплоемкости.
Средней теплоемкостью с ср данного процесса в интервале температур от t1 до t2 называется отношение количества теплоты сообщаемой газу, к разности конечной и начальной температур:
сср │t1t2=q/(t2 - t1 ) (24)
Выражение
с=δq/dТ (25)
определяет теплоемкость при данной температуре или так называемую истинную теплоемкость.
Из выражении (25) следует, что
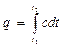 (26)
(26)
отсюда
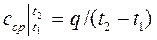
Для практических расчетов теплоемкости всех веществ сводят в таблицы, причем с целью сокращения объема таблиц средние теплоемкости приводят в них для интервала температур от 0 до t.
 2014-02-18
2014-02-18 699
699








