Все зависимости, полученные выше для идеальных газов, справедливы и для их смесей, если в них подставлять газовую постоянную, молекулярную массу и теплоемкость смеси.
Закон Дальтона. Газообразные вещества, близкие по свойствам к идеальным газам и представляющие собой механическую смесь отдельных компонентов различных газов, химически не реагирующие между собой, называются газовыми смесями. В качестве примера можно назвать продукты сгорания топлива в ДВС, топках печей и паровых котлов и т. п.
Основным законом, определяющим поведение газовой смеси, является закон Дальтона: полное давление смеси идеальных газов равно Сумме парциальных давлений всех входящих в нее компонентов:
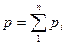 (68)
(68)
Парциальное давление рi – давление, которое бы имел газ, если бы он один при той же температуре занимал весь объем смеси.
Способы задания смеси. Состав газовой смеси может быть задан массовыми, объемными и мольными долями.
Массовой доле называется отношение массы отдельного компонента Мi к массе смеси М:
gi =М i/М (69)
Очевидно, что 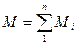 и
и 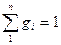 .
.
Объемная доля представляет собой отношение приведенного объема газа Vi к полному объему смеси V:
ri = Vi/ V (70)
Приведенным называется объем, который занимал бы компонент газа, если бы его давление и температура равнялись давлению и температуре смеси:
Vi =Vрi/р (71)
Мольной долей называется отношение количества молей Ni рассматриваемого компонента к общему количеству молей смеси N.
В соответствии с законом Авогадро объемы моля любого газа при одинаковых р и Т, в частности при температуре и давлении смеси, в идеально газовом состоянии одинаковы. Поэтому приведенный объем любого компонента может быть вычислен как произведение объема моля Vμ на число молей этого компонента, т. е. Vi = VμNi, а объем смеси – по формуле V = VμN. Тогда Vi / V= riNi/N, и следовательно, задание смеси идеальных газов мольными долями равнозначно заданию ее объемными долями.
 2014-02-18
2014-02-18 929
929








