Переход тела из кристаллического состояния в жидкое называют плавлением. Обратный процесс – кристаллизацией. Если твердое тело нагревать, то его внутренняя энергия, складывающаяся из кинетической энергии тепловых колебаний частиц в узлах кристаллической решетки и потенциальной энергии взаимодействия этих частиц, возрастает. При температуре плавления амплитуда колебаний частиц увеличивается настолько, что кристаллическая решетка начинает разрушаться, т.е. происходит плавление тела. Температура Tпл остается постоянной до тех пор, пока весь кристалл не расплавится, и только тогда температура жидкости вновь начнет повышаться. Количество теплоты, необходимое для расплавления 1 кг вещества, называется удельной теплотой плавления. Примерное изменение температуры со временем приведен на рис.1.
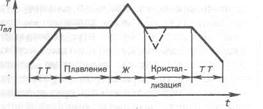
Рис.1.
Если получившуюся жидкость охлаждать, то процесс протекает в обратном направлении (рис. 1): сначала температура жидкости понижается, затем при постоянной температуре, равной Tпл, начинается кристаллизация, после ее завершения температура кристалла начинает понижаться. При кристаллизации происходит выделение теплоты фазового перехода. Для кристаллизации вещества необходимо наличие так называемых центров кристаллизации — кристаллических зародышей, которыми могут быть не только кристаллики образующегося вещества, но и примеси, а также пыль, сажа и т. д. Отсутствие центров кристаллизации в чистой жидкости затрудняет образование микроскопических кристалликов, и вещество, оставаясь в жидком состоянии, охлаждается до температуры, меньшей температуры кристаллизации, при этом образуется переохлажденная жидкость (на рис. 1 соответствует пунктирная кривая). При сильном переохлаждении начинается спонтанное образование центров кристаллизации и вещество кристаллизуется довольно быстро.
Обычно переохлаждение расплава происходит на величину от долей до десятков градусов, но для ряда веществ может достигать сотен градусов. Ввиду большой вязкости сильно переохлажденные жидкости теряют текучесть, сохраняя, как и твердые тела, свою форму. Эти тела получили название аморфных твердых тел; к ним относятся смолы, воск, сургуч, стекло. Аморфные тела, являясь переохлажденными жидкостями, изотропны, т. е. их свойства во всех направлениях одинаковы; для них, как и для жидкостей, характерен ближний порядок в расположении частиц; в них в отличие от жидкостей подвижность частиц довольно мала. Особенностью аморфных тел является отсутствие у них определенной точки плавления, т. е. невозможно указать определенную температуру, выше которой можно было бы констатировать жидкое состояние, а ниже — твердое. Из опыта известно, что в аморфных телах со временем может наблюдаться процесс кристаллизации, например в стекле появляются кристаллики; оно, теряя прозрачность, начинает мутнеть и превращаться в поликристаллическое тело.
Необходимо отметить, что существует также переход вещества из кристаллической фазы в газообразную, минуя жидкую фазу, который называется сублимацией или возгонкой.
Одно и то же вещество в зависимости от соотношения между средней кинетической и средней потенциальной энергиями частиц вещества может находиться в одном из трех агрегатных состояний: твердом, жидком или газообразном. Это соотношение, в свою очередь, определяется внешними условиями — температурой и давлением. Следовательно, фазовые превращения также определяются изменениями температуры и давления.
Для геометрического изображения фазовых превращений используется диаграмма состояния (рис. 2), на которой в координатах P, Т задается зависимость между температурой фазового перехода и давлением в виде кривых испарения (КИ), плавления (КП) и сублимации (КС), разделяющих поле диаграммы на три области, соответствующие условиям существования твердой (ТТ), жидкой (Ж) и газообразной (Г) фаз. Кривые на диаграмме называются кривыми фазового равновесия, каждая точка на них соответствует условиям равновесия двух сосуществующих фаз: КП — твердого тела и жидкости, КИ — жидкости и газа, КС -твердого тела и газа.
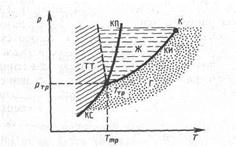
Рис.2.
Точка, в которой пересекаются эти кривые и которая, следовательно, определяет условия (температуру Ттр и соответствующее ей равновесное давление Pтр) одновременного равновесного сосуществования трех фаз вещества, называется тройной точкой. Каждое вещество имеет только одну тройную точку. Тройная точка воды характеризуется температурой 0,01°С при давлении 4,58 мм. рт. ст.
Диаграмма состояния, строящаяся на основе экспериментальных данных, позволяет судить, в каком состоянии находится данное вещество при определенных P и Т, а также какие фазовые переходы будут происходить при том или ином процессе. Например, при условиях, соответствующих точке 1 (рис. 3), вещество находится в твердом состоянии, точке 2 — в газообразном, а точке 3 — одновременно в жидком и газообразном состояниях. Допустим, что вещество в твердом состоянии, соответствующем точке 4, подвергается изобарному нагреванию, изображенному на диаграмме состояния горизонтальной пунктирной прямой 4-5-6. Из рисунка видно, что при температуре, соответствующей точке 5, вещество плавится, при более высокой температуре, соответствующей точке 6, — начинает превращаться в газ. Если же вещество находится в твердом состоянии, соответствующем точке 7, то при изобарном нагревании (пунктирная прямая 7-8)кристалл превращается в газ, минуя жидкую фазу. Если вещество находится в состоянии, соответствующем точке 9, то при изотермическом сжатии (пунктирная прямая 9-10)оно пройдет следующие три состояния: газ — жидкость — кристаллическое состояние.
На диаграмме состояний (см. рис. 2 и 3) видно, что кривая испарения заканчивается в критической точке К. Благодаря этому возможен непрерывный переход вещества из жидкого состояния в газообразное и обратно в обход критической точки, без пересечения кривой испарения (переход 11-12на рис. 3), т. е. такой переход, который не сопровождается фазовыми превращениями, так как оба сосьояния являются изотропными. Переход же кристаллического состояния (характеризуется анизотропией) в жидкое или газообразное может быть только скачкообразным (посредством фазового перехода), поэтому кривые плавления и сублимации не могут обрываться, как это имеет место для кривой испарения в критической точке. Кривая плавления уходит в бесконечность, а кривая сублимации идет в точку, где P = 0 и Т = 0.
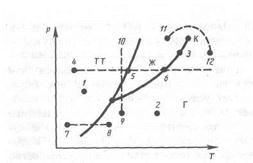
Рис.3.
Изменение температуры фазового перехода dT при изменении давления dP описывается уравнением Клапейрона — Клаузиуса
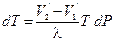
где l — теплота фазового перехода (например, теплота испарения, теплота плавления), V2‘ — V1‘ — изменение удельного объема вещества (объема, приходящегося на единицу массы) при переходе его из первой фазы во вторую, Т — температура перехода.
Поскольку l и Т положительны, при dP >0 знак dT определяется знаком V2‘ — V1‘. При испарении жидкостей и сублимации твердых тел объем вещества всегда возрастает, поэтому dT/dP > 0; следовательно, при этих процессах повышение внешнего давления приводит к увеличению температуры и наоборот. При плавлении большинства веществ объем, как правило, возрастает, т.е. dT/dP >0, следовательно, увеличение давления приводит к повышению температуры плавления (сплошная линия КП на рис. 2). Для некоторых же веществ (Н2О, чугун и др.) объем жидкой фазы меньше объема твердой фазы, т.е. dT/dP <0; следовательно, увеличение давления сопровождается понижением температуры плавления (пунктирная линия на рис. 2).
 2014-02-18
2014-02-18 3486
3486