Фаза —совокупность однородных, одинаковых по своим свойствам частей системы. При определенных условиях (p и T) две различные фазы одного и того же вещества могут находиться в равновесии. Существует также точка, при которой в равновесии могут находиться 3 фазы (тройная точка). Переход из одной фазы в другую называется фазовым переходом. Фазовые переходы, которые сопровождаются поглощением или выделением тепла (скрытой теплоты фазового перехода) называются фазовыми переходами первого рода. Существуют также фазовые переходы второго рода, при которых не происходит поглощение или выделение тепла, а скачком меняются некоторые параметры (переходы между кристаллическими модификациями, переход в сверхпроводящее состояние и т.п.).
Переход жидкости в газообразное состояние называется испарением, обратный процесс называется конденсацией. Переход в газообразное состояние твердого тела носит название сублимации.
Тепло q, которое необходимо сообщить единице массы вещества для того, чтобы превратить ее в пар, находящийся при той же температуре, какую имело вещество до испарения, называется удельной теплотой испарения (или сублимации). При конденсации тепло, затраченное при испарении, отдается обратно: образующаяся при конденсации жидкость (или твердое тело) нагревается.
Испарение (сублимация) происходят до наступления равновесия между газом и жидкостью (газом и твердым телом). При достижении определенного для данной температуры давления количества молекул, покидающих жидкость и возвращающихся в нее, станут равны. Начиная с этого момента, плотность пара перестает изменяться. Между жидкостью и паром установится динамическое равновесие, которое будет существовать до тех пор, пока не изменится объем или температура системы. Пар, находящийся в динамическом равновесии со своей жидкостью, называется насыщенным. Давление, при котором наблюдается равновесие, называется давлением (или упругостью) насыщенного пара. Давление насыщенного пара растет с температурой.
Рассмотрим процесс сжатия газа при постоянной температуре (т.е. получим изотерму реального газа). Вначале по мере уменьшения объема давление газа будет расти (рис.1). По достижении объема V гдавление перестает изменяться, а часть газа конденсируется в жидкость. Происходит расслоение вещества на две фазы: жидкую и газообразную. По мере дальнейшего уменьшения объема все большая часть газа переходит в жидкую фазу, причем переход осуществляется при постоянном давлении рнп (давлении насыщенного пара). Послетого как процесс конденсации вещества заканчивается (при достижении объема V ж ), дальнейшее уменьшение объема начинает сопровождаться быстрым ростом давления.
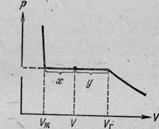
Рис.1
Отношение масс жидкости и насыщенного пара в двухфазном состоянии равно отношению отрезков, на которые делит горизонтальный участок изотермы точка, изображающая состояние.
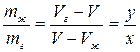
На рис.2 приведены изотермы для нескольких значений температуры. Из рисунка видно, что с повышением температуры горизонтальный участок изотермы сокращается, стягиваясь в точку, называемую критической точкой. Соответствующую этому состоянию температуру Т кр, объем V кр, давление p кр называют также критическими величинами. Отметим, что с ростом температуры плотность жидкости уменьшается, а насыщенного пара увеличивается и в критической точке различие между жидкостью и насыщенным паром исчезает (плотности жидкости и пара становятся равными). Газ выше критической температуры нельзя превратить в жидкость
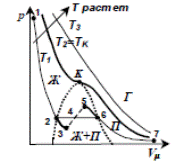
Рис. 2
Понятие критической температуры впервые было введено Д. И. Менделеевым. Он назвал ее температурой абсолютного кипения жидкости и рассматривал как температуру, при которой исчезают силы сцепления между молекулами и жидкость превращается в пар.
На рис.3 наложены одна на другую реальная изотерма и изотерма Ван-дер-Ваальса. Из сопоставления изотермы Ван-дер-Ваальса с реальной изотермой вытекает, что они примерно совпадают на участках, отвечающих однофазным состояниям вещества (газу и жидкости), но ведут себя совершенно различным образом в области расслоения на две фазы (где существуют насыщенный пар и жидкость). Вместо S-образного завитка на изотерме Ван-дер-Ваальса реальная изотерма имеет в этой области прямолинейный горизонтальный участок.
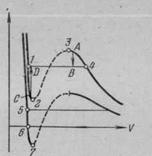 |
 |
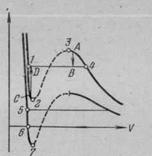 |
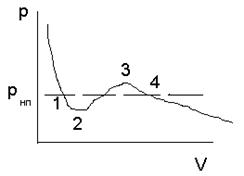
Рис.3
Расслоение на две фазы объясняется неустойчивостью однородных состояний, отвечающих завитку 1—2—3—4. Неустойчивость участка 2—3 очевидна, так как увеличение объема газа должно сопровождаться ростом давления, что невозможно.
Участки 1—2 и 3—4 могут быть реализованы, но при особых условиях, и являются неустойчивыми. Подобные неустойчивые состояния называются также метастабильными. Вещество в состояниях 1—2 называется перегретой жидкостью (с температурой большей температуры кипения при данном давлении), вещество в состояниях 3—4 называется пересыщенным паром (он находится при давлении, превышающем давление насыщенных паров при данной температуре).
Условия реализации перегретой жидкости и пересыщенного пара – отсутствие центров парообразования и конденсации (посторонних включений - пылинок, капелек жидкости и заряженных частицы и т.д.). Такие состояния очень неустойчивы: достаточно возникнуть хотя бы одному центру парообразования или конденсации, как состояние перегретой жидкости или пересыщенного пара будет нарушено и вещество перейдет в двухфазное состояние.
 2014-02-18
2014-02-18 4111
4111
