Процесс, происходящий без теплообмена с окружающей средой, называется адиабатным. Согласно определению dq = 0, для того чтобы осуществить такой процесс, следует либо теплоизолировать газ, т.е. поместить его в адиабатную оболочку, либо провести процесс настолько быстро, чтобы изменение температуры газа, обусловленное его теплообменом с окружающей средой, было пренебрежимо мало по сравнению с изменением температуры, вызванным расширением или сжатием газа.
Уравнения первого закона термодинамики для адиабатного процесса принимают вид:
сp dT – v dp = 0 и cv dT + p dv = 0.
Поделив первое уравнение на второе, получим:
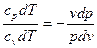 , или
, или 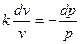 .
.
Интегрируя последнее уравнение при условии, что k = cp/ cv = const,находим:
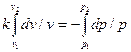 и
и
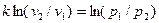 .
.
После потенцирования имеем:
(v 2 / v 1) k = p 1/ p 2,
или 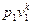 =
= 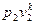 . (4.16)
. (4.16)
Это и есть уравнения адиабаты идеального газа при постоянном отношении теплоемкостей (k = const).Величина
k = cp/ cv (4.17)
называется показателем адиабаты. Подставив сp = сv + R, получим k = 1+ R / сv.
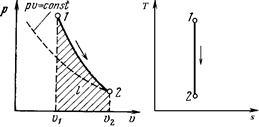
Изображение адиабатного процесса в p,v – и T,s – координатах.
Поскольку k > 1, то в координатах р,v линия адиабаты идет круче линии изотермы: при адиабатном расширении давление понижается быстрее, чем при изотермическом, так как в процессе расширения уменьшается температура газа.
Определив из уравнения состояния, написанного для состояний 1 и 2, отношение объемов или давлений и подставив их в (4.16), получим уравнение адиабатного процесса в форме, выражающей зависимость температуры от объема или давления:
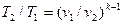 ;
;
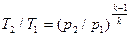 . (4.18)
. (4.18)
Работа расширения при адиабатном процессе согласно первому закону термодинамики совершается за счет уменьшения внутренней энергии и может быть вычислена по одной из следующих формул:
l = – Du = сv (Т 1 – Т 2) =
= 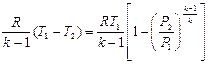 ; (4.19)
; (4.19)
т.к. p1v1 = RT1 и p2v2 = RT2, то
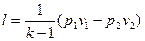 . (4.20)
. (4.20)
В данном процессе теплообмен газа с окружающей средой исключается, поэтому q = 0. Выражение с = dq/ dT показывает, что теплоемкость адиабатного процесса равна нулю.
Поскольку при адиабатном процессе dq = 0, энтропия рабочего тела не изменяется (ds = 0 и s = const). Следовательно, на Т, s – диаграмме адиабатный процесс изображается вертикалью.
 2014-02-18
2014-02-18 1662
1662
