Таблица 20.7. Семейство протеаз внеклеточного матрикса и их субстратная специфичность
Молекулы межклеточного матрикса быстро распадаются
Образование матрикса, его распад или ремоделирование - все это важные и необходимые процессы, участвующие при перестройке тканей. Они сопутствуют развитию организма, заживлению ран, некрозу опухолей или воспалению.
Ключевыми компонентами обмена молекул внеклеточного матрикса и его регуляции являются металлопротеазы матрикса (МПМ) и их ингибиторы (тканевые ингибиторы металлопротеаз матрикса ТИМПМ). Семейство МПМ состоит из металлопротеаз матрикса мембранного типа (МПМ-МТ), которые активируют прожелатиназу А, и каскада металлопротеаз матрикса, которые полностью разрушают молекулы матрикса.
МПМ - это группа ферментов, активность которых зависит от цинка. Они катализируют распад молекул внеклеточного матрикса (протеогликаны, гликопротеины и различные типы коллагена). Клетки секретируют МПМ в форме прометаллопротеаз. Механизм их активирования in vivo пока не известен.
| Фермент | Молекулярная масса | Субстрат |
| МПМ | ||
| Желатиназы 72 кД желатиназа (МПМ-2; тип IV, коллагеназа А) | Денатурированный коллаген, Коллаген IV, V, VII, X, эластин, фибронектин | |
| 92-кД желатиназа (МПМ-9; тип IV коллагеназа B) | Желатин, коллаген IV, V, фибронектин | |
| Коллагеназы Интерстициальная коллагеназа (фибробластный тип коллагеназы, МПМ-1) | Колаген типов I-III, VII, VIII, X | |
| Нейтрофильная коллагеназа (ПМЯ тип коллагеназы, МПМ-8) | 75-85 | Коллаген типов I-III |
| Коллагеназа-3 (МПМ-13) | Коллаген типов I-III, VII VIII, X | |
| Стромализины Стромализин-1 (МПМ-3; Транзин) | 57-60 | Протеогликаны, фибронектин, ламинин, денатурированный коллаген |
| Стромализин-2 (МПМ-10, Транзин-2) | Коллаген III-IV, фибронектин, желатин, предшественники МПМ | |
| Стромализин-3 (МПМ-11) | альфа-1-антитрипсин | |
| Матрилизин (МПМ-7, pump-1) | Фибронектин, ламинин, протеогликаны, желатин, эластин, энтактин | |
| Металлоэластаза (МПМ-12) | Эластин, фибронектин | |
| Мембранные МПМ MT-МПМ (МПМ-14) MT-МПМ-2 MT-МПМ-3 | Прожелатиназа-А | |
| Сериновые протеиназы | ||
| Урокиназный тип активатора плазминогена | Гликопротеины, аморфный коллаген | |
| Тканевой активатор плазминогена | Гликопротеины, аморфный коллаген |
Примечание: pump-1 - путативная металлопротеиназа
Полагают, что активирование ферментов часто осуществляется путем аутокатализа, результатом которого является удаление N-концевого пептида протеазы. In vitro МПМ могут быть активированы детергентами или органическими производными ртути и такими протеолитическими ферментами как плазмин, трипсин, калликреин, стромализин. Все эти агенты индуцируют конформационные изменения, направленные на образование промежуточной формы частично активированного фермента, который аутокаталитически удаляет часть молекулы с образованием полностью активного фермента.
Биологическое время полураспада БУК колеблется от нескольких дней (протеогликаны кожи) до нескольких месяцев (зрелый коллаген кожи).
Химические компоненты хряща
Одним из главных химических компонентов хряща является тип II коллагена. Другим важным компонентом является специфический для хряща протеогликан. Конечная функция хряща определяется функцией этих 2 основных типов молекул. Коллагеновые волокна, прочные на разрыв, усиливают механические свойства довольно непрочного протеогликана. Ориентация коллагеновых волокон определяется направлением воздействий, которым эта ткань противостоит. Протеогликан образует гель, который в 5 раз больше по объему в воде, чем в окружении коллагена. Причем, возможности связывания воды гелем зависят от взаимодействия между этими двумя основными белками хряща. Не исключено, что на это свойство влияют и другие белки хряща.
Главный коллагеновый белок хряща - коллаген II типа [a(II)]3.Он состоит из 3 одинаковых a-цепей, гомологичных по аминокислотному составу a-цепям коллагена кожи. Коллаген II типа относится к классу главных структурных коллагенов, для которых характерно образование поперечно исчерченных прочных фибрилл. Его волокна разнообразны по диаметру, но, как правило, они тоньше волокон коллагена I типа и имеют больше поперечных ковалентных связей. Из хряща выделены и другие типы коллагена, которые составляют около 10 % от общего количества коллагена в хряще. Эти минорные коллагены отличаются по аминокислотному составу, молекулярной массе и свойствам. Их роль пока еще недостаточно хорошо выяснена.
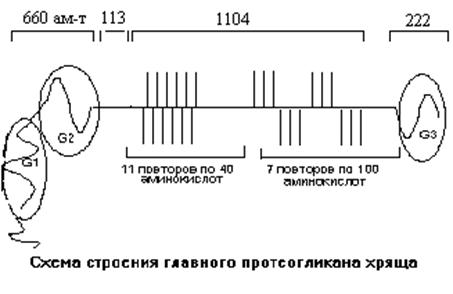
Главный протеогликан хряща занимает 5-10% от влажного веса хряща. К белковому компоненту протеогликана с ММ 210000 Да присоединяется ковалентными связями несколько типов боковых цепей. В белке ПГ выделяют несколько доменов. На N-конце имеется глобулярный домен (G1), имеющий одну одиночную и одну двойную петли. При помощи этого домена белковая цепь ПГ взаимодействует с гиалуроновой кислотой. Место контакта образовано из 5 дисахаридных структур гиалуроновой кислоты. Несколько таких белковых цепей ПГ могут взаимодействовать с одной молекулой гиалуроновой кислоты. Связь между белком и гиалуроновой кислотой усиливается при помощи специального связывающего белка. По своей структурной организации этот белок гомологичен домену белковой части ПГ, связывющемуся с гиалуроновой кислотой.
 2014-02-18
2014-02-18 965
965








