СОСТАВ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ПРИРОДНЫХ ГАЗОВ
Природные газы – это вещества, которые при нормальных (н.у.) и стандартных (с.у.) условиях являются газообразными. В зависимости от условий газы могут находиться в свободном, адсорбированном или растворённом состояниях.
В пластовых условиях газы в зависимости от их состава, давления и температуры (термобарического режима в пласте) могут находиться в различных агрегатных состояниях – газообразном, жидком, в виде газожидкостных смесей.
Свободный газ обычно расположен в повышенной части пласта и находится в газовой шапке. Если газовая шапка в нефтяной залежи отсутствует, то весь газ залежи растворён в нефти.
Давление, при котором имеющийся в залежи газ начинает выделяться из нефти, называется давлением насыщения. Давление насыщения нефти газом в пластовых условиях определяется составами, количеством нефти и газа, пластовой температурой.
Растворённый газ, по мере снижения давления при добыче, выделяется из нефти. Он называться попутным газом. В пластовых условиях все нефти содержат растворённый газ. Чем выше давление в пласте, тем больше газа может быть растворено в нефти. В 1 м3 нефти содержание растворённого газа может достигать 1000 м3.
Природные газы, добываемые из газовых, газоконденсатных и нефтяных месторождений, состоят из углеводородов (УВ) метанового ряда СН4–С4Н10: метана, этана, пропана, изобутана и н-бутана, а также неуглеводородных компонентов: H2S, N2, CO, CO2, H2, Ar, He, Kr, Xe и других.
При нормальных и стандартных условиях термодинамически в газообразном состоянии существуют только УВ состава С1–С4. Углеводороды алканового ряда, начиная с пентана и выше, при этих условиях находятся в жидком состоянии, температуры кипения для изо-С5 равна 28оС, а для н-С5 → 36оС. Однако, в попутных газах иногда наблюдаются углеводороды С5 за счёт термобарических условий, фазовых переходов и других явлений.
Качественный состав газов нефтяного происхождения всегда одинаков (что нельзя сказать о газах вулканических извержений). Количественное распределение компонентов практически всегда различно.
Состав газовых смесей выражается в виде массовой или объемной концентрации компонентов в процентах и мольных доля х.
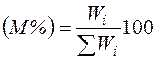 , (2.15)
, (2.15)
где Wi - масса i-го компонента; ΣWi - суммарная масса смеси.
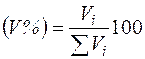 , (2.16)
, (2.16)
где Vi - объем i-го компонента в смеси; Σ Vi - суммарный объем газа.
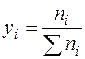 , (2.17)
, (2.17)
где ni - число молей i-го компонента в смеси; Σпi - суммарное число молей газа в системе.
Зависимость между объемной и мольной концентрациями компонентов вытекает из закона Авогадро. Так как равные объемы любых газов при одинаковых температуре и давлении содержат одинаковое число молекул, то объем i-го компонента смеси будет пропорционален числу молей i-го компонента:
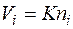 , (2.18)
, (2.18)
где К — коэффициент пропорциональности. Следовательно
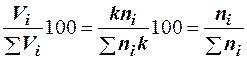 , (2.19)
, (2.19)
т. е. концентрация компонента в процентах по молям (% мол.) в смеси газов при атмосферном давлении практически совпадает с объемной концентрацией этого компонента в процентах (% об.).
При высоких давлениях жидкие углеводороды растворяются в газовой фазе (газовые растворы, газоконденсаты). Поэтому при высоких давлениях плотность газа может приближаться к плотности легких углеводородных жидкостей.
В зависимости от преобладания в нефтяных газах легких (метан, этан) или тяжелых (пропан и выше) углеводородов газы разделяются на сухие и жирные.
Сухим газом называют природный газ, который не содержит тяжелых углеводородов или содержит их в незначительных количествах.
Жирным газом называют газ, содержащий тяжелые углеводороды в таких количествах, когда из него целесообразно получать сжиженные газы или газовые бензины.
На практике принято считать жирным газом такой, в 1 м3 которого содержится более 60г газового бензина.
Газы, добываемые из чисто газовых месторождений, содержат более 95 % метана (табл. 2.2) и представляют собой, так называемые, сухие газы.
Таблица 2.2
| Месторождение | СН4 | С2Н6 | С3Н8 | С4Н10 | N2 | СО2 | Относит. плотность |
| Северо-Ставропольское | 98,9 | 0,29 | 0,16 | 0,05 | 0,4 | 0,2 | 0,56 |
| Уренгойское | 98,84 | 0,1 | 0,03 | 0,03 | 1,7 | 0,3 | 0,56 |
| Шатлыкское | 95,58 | 1,99 | 0,35 | 0,15 | 0,78 | 1,15 | 0,58 |
| Медвежье | 98,78 | 0,1 | 0,02 | – | 1,0 | 0,1 | 0,56 |
| Заполярное | 98,6 | 0,17 | 0,02 | 0,013 | 1,1 | 0,18 | 0,56 |
Тяжёлым нефтям свойственны сухие попутные газы с преобладанием метана в их составе. Например, содержание метана в составе попутного газа Русского месторождения Западной Сибири (плотность нефти более 920 кг/м3) аналогично содержанию метана в составе газа газового Уренгойского месторождения и составляет около 98,8 об. %.
Содержание метана в газах газоконденсатных месторождений колеблется в интервале 75–95 % (табл. 2.3). Попутный газ газоконденсатных месторождений и лёгких нефтей достаточно жирный.
Таблица 2.3
| Месторождение | СН4 | С2Н6 | С3Н8 | С4Н10 | С5Н12 | N2 | СО2 | Отност. плотность | |
| Вуктыльское | 74,80 | 8,70 | 3,90 | 1,80 | 6,40 | 4,30 | 0,10 | 0,882 | |
| Оренбургское | 84,00 | 5,00 | 1,60 | 0,70 | 1,80 | 3,5 | 0,5 | 0,680 | |
| Ямбургское | 89,67 | 4,39 | 1,64 | 0,74 | 2,36 | 0,26 | 0,94 | 0,713 | |
| Уренгойское (БУ–8, БУ–14) | 88,28 | 5,29 | 2,42 | 1,00 | 2,52 | 0,48 | 0,01 | 0,707 |
Газы, добываемые вместе с нефтью из нефтяных месторождений (попутные газы) представляют собой смесь метана, этана, пропан-бутановой фракции, газового бензина. При повышенном давлении углеводороды состава С3, С4 легко сжижаются. В пластовых условиях в газообразном состоянии находится практически один метан. При нормальных условиях углеводороды от метана СН4 до бутана С4Н10 находятся в газообразном состоянии. Остальные углеводороды при этих условиях — жидкости. Пропан и бутан при повышении давления легко переходят в жидкое состояние. Упругость насыщенных паров углеводородов, т. е. то давление, при котором газ начинает конденсироваться и переходить в жидкое состояние, повышается с ростом температуры и она тем выше, чем ниже плотность углеводорода. Упругость пара — нелинейная функция температуры. Графики на рис. 2.9 построены так, чтобы получить линейную зависимость между упругостью паров углеводородов и температурой: шкала упругости пара принята логарифмической, а температурная шкала (в °С) принята произвольной.
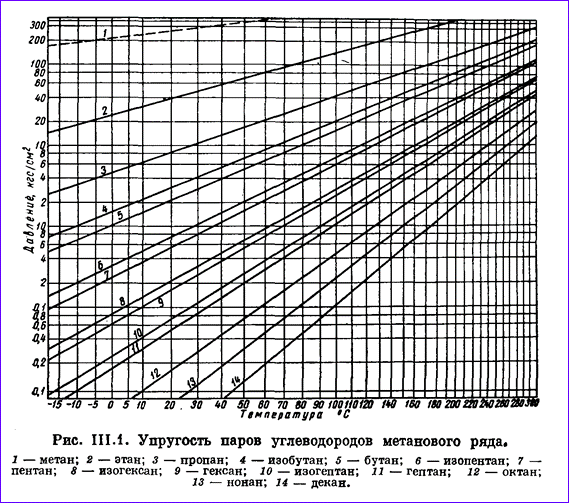
Рис.2.9
Удобство таких графиков заключается в том, что они позволяют легко и быстро определять по известной упругости пара при некоторой температуре упругость его паров при других температурах. Для этого проводят прямую линию через, известную точку и общую точку пересечения прямых упругостей паров (находящуюся вне графика на продолжении правой верхней части диаграммы).
Из рис. 2.9 следует, что давление паров метана наибольшее; при нормальных условиях его нельзя превратить в жидкость (пунктирная линия 1 давления ненасыщенного пара метана), так как его критическая температура t = -82,95° С. Давление насыщенных паров других углеводородов намного ниже. Например, бутан при t = - 20° С имеет упругость паров, равную 0,22 Мн/м2 (2,2 кГ/см2).
К расчёту физико-химических свойств газа как многокомпонентной смеси можно применять принцип аддитивности.
Аддитивный подход к расчёту физико-химических и технологических параметров означает, что каждый компонент газа в смеси ведёт себя так, как если бы он в данной смеси был один.
Следовательно, для оценки макроскопических свойств нефтяного газа (при н.у. и с.у.) применимы аддитивные методы расчётов физико-химических и технологических параметров (Псмеси):
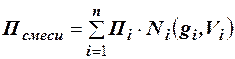 , (2.20)
, (2.20)
где где Ni – мольная доля; gi – весовая доля; Vi – объёмная доля; Пi – физико-химическое свойство i-го компонента.
Для идеальных газов общее давление в системе (смеси газов) равно сумме парциальных давлений компонентов (закон Дальтона):
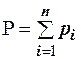 , (2.21)
, (2.21)
где Р – общее давление смеси газов; рi – парциальное давление i-го компонента в смеси. Откуда
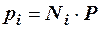 , (2.22)
, (2.22)
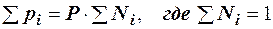 . (2.23)
. (2.23)
То есть, парциальное давление компонента в газовой смеси равно произведению его молярной доли на общее давление смеси газов.
Аддитивность парциальных объёмов (Vi) компонентов газовой смеси выражается законом Амага:
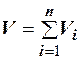 , (2.24)
, (2.24)
где V – общий объём смеси газов; Vi – мольный объём i-го компонента газа в смеси.
По аналогии с уравнениями (2.22–2.23) мольный объём компонента в газе можно оценить:
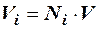 . (2.25)
. (2.25)
Как аддитивные величины рассчитывают все физико-химические свойства газа, например, плотность смеси газов:
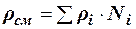 , (2.26)
, (2.26)
где ρi – плотность i–го компонента; Ni – мольная доля i–го компонента.
 2014-02-09
2014-02-09 7738
7738
