Водные растворы различных соединений могут давать кислую, щелочную или нейтральную реакцию. Реакция среды зависит от соотношения концентраций ионов гидроксония и гидроксид–ионов в растворе.
Если концентрации этих ионов равны между собой, то есть [Н3О+] = [ОН-], то реакция среды нейтральная. Следовательно, вода принадлежит к типичным амфотерным соединениям, совмещающим кислотные и основные свойства, выраженные в одинаковой степени.
Если концентрация ионов гидроксония больше концентрации гидроксид–ионов, то есть [Н3О+] > [ОН-], то реакция среды становится кислой. Кислотность тем выше, чем больше концентрация ионов гидроксония. Если наоборот, концентрация ионов гидроксония меньше концентрации гидроксид–ионов, то есть [Н3О+] < [ОН-], то реакция среды становится щелочной. Следовательно, по значению концентрации этих ионов можно количественно охарактеризовать реакцию среды.
Кислотность или основность раствора можно выразить, взяв вместо концентрации ионов водорода ее десятичный логарифм. Чтобы избавиться от отрицательной степени в значении концентрации ионов водорода, предложено пользоваться отрицательным значением логарифма величины [Н+], названным водородным показателем или рН:
рН = -lg[Н+];
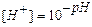
В практике принимается Kw = 10-14 (22 °С), отсюда [Н+] = 10-7 г-ион/л и рН = 7.
Соотношения между реакцией среды, концентрациями ионов и значением водородного показателя получаются следующие:
Нейтральная среда [Н3О+] = [ОН-] = 10-7 г-ион/л, рН = 7.
Кислотная среда [Н3О+] > [ОН-] > 10-7 г-ион/л, рН < 7.
Щелочная среда [Н3О+] < [ОН-] < 10-7 г-ион/л, рН > 7.
Это можно представить в виде схемы:

Гидролиз – процесс взаимодействия ионов соли с водой, приводящий к образованию слабого электролита.
Если соль рассматривать как продукт взаимодействия кислоты с основанием, то в зависимости от их силы все соли можно разделить на четыре типа по приведенной схеме.
Таблица: 1
| Кислоты | |||
| Сильные | Слабые | ||
| Основания | Сильные | I: NaCl, KNO3; pH=7 гидролиз не идет | II: Na2CO3, K2S; рH > 7 |
| Слабые | III: ZnCl2, Al(NO3)3; pН < 7 | IV: CH3COONH4, Al2S3 |
Соли первого типа гидролизу не подвергаются, так как при их взаимодействии с водой слабые электролиты не могут быть получены. В системе Н2О ↔ Н+ + ОН- не нарушается равновесие. рН в растворах этих солей будет равно 7.
Рассмотрим гидролиз солей оставшихся трех типов. Соли, образованные многоосновными кислотами или многокислотными основаниями, гидролизируются ступенчато, переходя в первой фазе в кислотные или основные соли.
Гидролиз Na2CO3:
I ступень 2Na+ + CO32- + HOH <=> Na+ + HCO3- + Na+ + OH-
CO32- + HOH <=> HCO3- + OH-;
II ступень Na+ + HCO3- + HOH <=> H2CO3 + Na+ + OH-
HCO3- + HOH <=> H2CO3 + OH-.
При гидролизе Na2CO3 и других солей этого типа в растворе накапливаются ионы OH-, сообщающие ему щелочную реакцию с рН > 7. Более сильно выражена первая ступень гидролиза, чем вторая.
Гидролиз ZnCl2:
I ступень: Zn2+ + 2Cl- + HOH <=> ZnOH+ + Cl- + H+ + Cl-
Zn2+ + HOH <=> ZnOH+ + H+;
II ступень: ZnOH+ + HOH + Cl- <=> Zn(OH)2 + H+ + Cl-
ZnOH+ + HOH <=> Zn(OH)2 + H+.
При гидролизе ZnCl2 и других солей этого типа в растворе накапливаются ионы H+, сообщающие ему кислотную реакцию с рН < 7.
Гидролиз СН3СООNH4:
NH4 + CH3COO- + HOH <=> NH4OH + CH3COOH.
Соли этого типа подвергаются гидролизу относительно легко. Реакция и рН раствора определяется относительной силой образующихся оснований и кислот. В рассматриваемом случае константы электролитической диссоциации NH4OH и CH3COOH при 25 ºС соответственно равны 1,79·10-5 и 1,76·10-5, а поэтому реакция раствора практически нейтральна (рН = 7).
Процесс гидролиза солей количественно может быть охарактеризован с помощью двух величин: степени гидролиза h, константы гидролиза Кгидр.
Степенью гидролиза называется отношение количества молекул соли, подвергшихся гидролизу, к общему количеству молекул соли в растворе.
Очевидно, степень гидролиза h может изменяться в следующих пределах:
гидролиз полный
отсутствует гидролиз
0 £ h £ 1 в долях единицы
0 £ h £ 100 в %
Константа гидролиза определяет состояние химического равновесия в растворе гидролизированной соли.
Например, для равновесного состояния I ступени гидролиза Na2CO3 и ZnCl2 Кгидр выразится уравнениями:
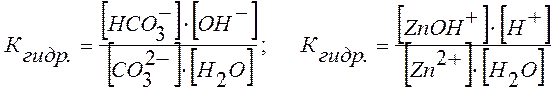 .
.
В общем случае Кгидр изменяется в следующих пределах:
гидролиз полный
отсутствует гидролиз
0 £ Кгидр £ 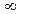 .
.
На состояние равновесия гидролиза сильно влияют различные факторы: главным образом концентрация воды в растворе и температура системы.
Как видно из общего уравнения гидролиза
соль + вода <=> основание + кислота
и уравнения константы гидролиза
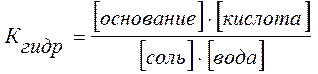
увеличение концентрации воды (или изменение концентрации соли) в растворе в силу постоянства Кгидр смещает равновесие слева направо. Поэтому разбавленные растворы солей гидролизируются полнее и быстрее, чем концентрированные, и степень гидролиза возрастает с разбавлением раствора.
Изменение температуры также резко влияет на состояние гидролитического равновесия: при повышении температуры степень гидролиза увеличивается, что объясняется резким возрастанием ионного произведения воды.
Литература
1. Глинка Н.Л. Общая химия. – М.: Химия, 1978. – С. 228-260.
2. Шиманович И.Е., Павлович М.Л., Тикавый В.Ф., Малашко П.М. Общая химия в формулах определениях, схемах. – Мн.: Унiверсiтэцкае, 1996. – С. 121-136.
3. Воробьев В.К., Елисеев С.Ю., Врублевский А.В. Практические и самостоятельные работы по химии. – Мн.: УП «Донарит», 2005. – С. 52-65.
Тема 8. Бинарные жидкие системы
Рассматриваемые вопросы:
1. Характеристика жидкого состояния вещества.
2. Давление насыщенного пара бинарных систем.
3. Перегонка жидких смесей. Ректификация.
 2014-02-24
2014-02-24 2584
2584








