Химическая и технологическая схема производства стали
Марки сталей
Производство стали
Лекция 10
Сталь – деформируемый (ковкий) сплав железа с углеродом (до 2%) и другими элементами.
Сталь – важнейший материал, применяемый в большинстве отраслей промышленности.
Масштаб производства стали является одной из основных характеристик общего технико-экономического уровня развития государства.
На долю стали приходится около 95% всей металлической продукции.
!!! Сталь получают путём передела белого (передельного) чугуна с добавлением скрапа, представляющего собой металлические отходы, и железной руды.
Сущность различных методов получения стали заключается:
1) в уменьшении (путём окисления) содержания углерода, кремния и марганца в сплаве до определённых величин;
2) в возможно более полном удалении вредных примесей – серы и фосфора.
Все эти элементы (кроме серы, присутствующей в виде FeS), превращаются в оксиды.
Затем оксиды удаляются из сплава в виде:
газа (CO);
или после взаимодействия с флюсами - в виде шлака (жидкая фаза: FeO, MnO, P2O5, CaS).
Таким образом, в противоположность доменному процессу, где преобладают реакции восстановления оксидов, здесь, наоборот, протекают реакции окисления.
В качестве окислителей используют кислород и оксид железа (II) FeO.
В зависимости от области применения выпускается большое число марок сталей, различающихся по химическому составу, структуре, физическим и механическим свойствам.
1) По химическому составу стали делятся на углеродистые и легированные стали.
Углеродистая сталь наряду с железом и углеродом содержит марганец (0,1-1,0%) и кремний (до 0,4%).
Для придания стали каких-либо особых свойств – механических, электрических, магнитных, коррозионной устойчивости и т.д. – в нее вводят так называемые легирующие элементы.
К легирующим элементам относятся металлы: хром, никель, молибден, алюминий и др. Такие стали называют легированными.
2) По назначению стали делятся на конструкционные, инструментальные и стали с особыми свойствами (электротехнические, нержавеющие, кислотостойкие и др.).
В настоящее время используются следующие способы выплавки стали:
- кислородно-конверторный (более 60% от всей выплавляемой в мире стали);
- электросталеплавильный (около 25%);
- мартеновский (около 20%).
Исходными материалами для производства стали служат жидкий или твёрдый передельный чугун, металлолом (скрап), высококачественная железная руда и флюсы.
Первая стадия - образование оксида железа (II) FeO..
При температуре 1250 - 1600 ºС происходит плавление железосодержащих материалов, и кислород воздуха окисляет железо до оксида железа:
2Fe + O2 = 2FeO
Одновременно, высшие оксиды железа, содержащиеся в чугуне и стальном ломе, восстанавливаются железом:
Fe2O3 + Fe = 3FeO
Вторая стадия – окисление примесей (металлов и неметаллов) до оксидов.
Оксид железа (II), хорошо растворяясь в чугуне, окисляет растворённые в нём металлы:
Mn + FeO = MnO + Fе
Si + 2FeO = SiO2 + 2Fе
2P + 5FeO = P2O5 +5Fe
Частично эти элементы окисляются и кислородом воздуха:
2Mn + O2 = 2MnO
Si + O2 = SiO2
Третья стадия – образование шлака.
Образовавшихся основные и кислотныеоксиды различных элементов взаимодействуют с флюсами и превращаются в шлак. Основным источником шлакообразования становится оксид кальция (CaO), поступающий с флюсами.
В шлак частично переходит и сера, так как сульфид кальция не растворим в металле:
FeS + CaO = FeO + CaS
Четвёртая стадия - окисление углерода до оксида углерода (II).
С ростом температуры до 1600 ºС и выше начинается интенсивно окисляться углерод:
FeO + C = Fe + CO
Благодаря интенсивному выделению пузырьков оксида углерода (II) металл как бы «кипит» (период «кипения» стали).
Пятая стадия – раскисление стали.
После достижения в расплаве установленного содержания углерода (менее 2%) шлак удаляют и вводят в сталь раскислители.
В качестве реагентов для раскисления, восстанавливающих и связывающих растворённый в стали кислород, используются элементы с б о льшим сродством к кислороду, чем железо: Mn, Si и Al в виде соответствующих ферросплавов (ферросилиций и ферромарганец):
Mn + FeO = MnO + Fе
2Si + FeO = SiO2 + Fе
Одновременно с восстановлением оксида железа (FeO) происходит процесс перевода растворенного в стали кислорода в нерастворимые в металле оксиды и отделения их от стали:
2Mn + O2 = 2MnO
Si + O2 = SiO2
Образовавшиеся оксиды раскисляющих элементов переходят в шлак.
Обычно процесс раскисления стали совмещается с введением в неё легирующих добавок в виде ферросплавов, содержащих соответствующие легирующие элементы хром, никель, молибден, алюминий и др.
Основное отличие мартеновского процесса от других методов выплавки стали:
использование в качестве источника теплоты - реакций сгорания газообразного топлива (природный газ, смесь коксового и доменного газов) непосредственно в печи.
Исходными материалами для мартеновского процесса служат жидкий или твёрдый передельный чугун, металлолом (скрап) высококачественная железная руда и флюсы.
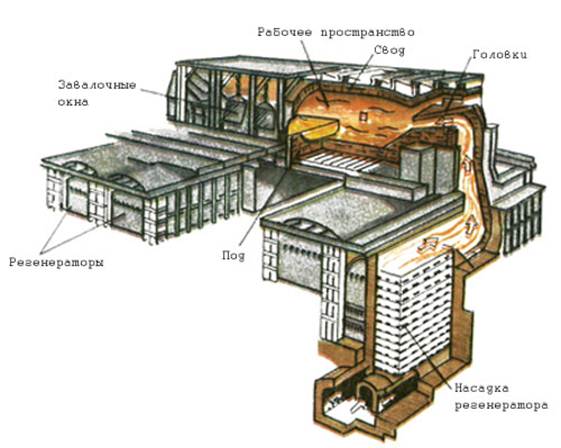
Мартеновский процесс выплавки стали ведут в пламенных отражательных печах, в которых используют регенерацию теплоты отходящих газов.
Современная мартеновская печь представляет собой вытянутую в горизонтальном направлении камеру, сложенную из огнеупорного кирпича (Рис. 10.1):
 2014-02-24
2014-02-24 1158
1158