Термодинамика - наука, которая изучают закономерности, не связанные с конкретной структурой вещества.
РАВНОВЕСНАЯ И НЕРАВНОВЕСНАЯ ТЕРМОДИНАМИКА В БИОЛОГИИ
Курс лекций по дисциплине
«Экономика»
Для студентов технических специальностей
Заочной формы обучения
Редактор С.И. Семухина
Подписано в печать Формат 60 84/16
Бумага офсетная. Усл. Печ. Л.
Тираж 500 экз. Заказ
Издательство УрГУПС
620034, Екатеринбург, ул. Колмогорова, 66
Важнейшее свойство живых организмов заключается в их способности
улавливать, преобразовывать и запасать энергию в различных формах. Общие законы, определяющие превращения энергии, изучаются термодинамикой.
Законы термодинамики универсальны для неживой и живой природы, но,
формулируя их, мы не исследуем конкретной сущности процессов, происходящих при нагревании воды или при развитии эмбриона.
Классическая термодинамика (ее три «начала») изучает термодинамические равновесные, обратимые процессы. Для неравновесных процессов она устанавливает лишь неравенства, которые указывают возможное направление этих процессов.
В отличие от классической термодинамики, в термодинамике необратимых
процессов рассматривается ход процессов во времени. Фундаментальное
понятие классической термодинамики — равновесное состояние. В
Равновесные (или обратимые) процессы протекают в системе таким образом, что вызванные ими изменения в состоянии системы могут произойти в обратной последовательности без дополнительных изменений в окружающей среде.
Неравновесные (или необратимые) процессы вызывают обязательные изменения в окружающей среде.
Фундаментальными работами Ильи Романовича Пригожина установлено, что вся термодинамика делится на три большие области: равновесную, в которой производство энтропии, потоки и силы равны нулю, слабо неравновесную, в которой термодинамические силы «слабы», и энергетические потоки линейно зависят от сил, и сильно неравновесную, или нелинейную, где энергетические потоки нелинейны, а все термодинамические процессы носят необратимый характер.
Основная задача неравновесной термодинамики - количественное изучение неравновесных процессов, в частности определение их скоростей в зависимости от внешних условий. В неравновесной термодинамике системы, в которых протекают неравновесные процессы, рассматриваются как непрерывные среды, а их параметры состояния — как, непрерывные функции координат и времени.
Слабо неравновесная (линейная) термодинамика рассматривает термодинамические процессы, происходящие в системах в состояниях, близких к равновесию. Таким образом, линейная термодинамика описывает стабильное, предсказуемое поведение систем, стремящихся к минимальному уровню активности. Первые работы в этой области принадлежат Ларсу Онзагеру, который в 1931 году впервые открыл общие соотношения неравновесной термодинамики в линейной, слабо неравновесной области - «соотношения взаимности». Суть их чисто качественно сводится к следующему: если сила «один» (например, градиент температуры) для слабо неравновесных ситуаций воздействует на поток «два» (например, на диффузию), то сила «два» (градиент концентрации) воздействует на поток «один» (поток тепла).
Таким образом, в слабо неравновесной области практически действуют законы равновесной термодинамики, система ни к чему не стремится и ее поведение в большинстве случаев вполне предсказуемо.
Сильно неравновесная термодинамика рассматривает процессы, происходящие в системах, состояние которых далеко от равновесия.
Когда термодинамические силы, действуя на систему, становятся достаточно большими и выводят ее из линейной области в нелинейную, устойчивость состояния системы и ее независимость от флуктуации значительно уменьшается.
В таких состояниях определенные флуктуации усиливают свое воздействие над системой, вынуждая ее при достижении точки бифуркации – потери устойчивости, эволюционировать к новому состоянию, который может быть качественно отличным от исходного. Происходит самоорганизация системы. Причем считается, что развитие таких систем протекает путем образования нарастающей упорядоченности. На этой основе и возникло представление о самоорганизации материальных систем.
Все материальные системы, от самых малых до самых больших, считаются открытыми, обменивающимися энергией и веществом с окружающей средой и находящимися, как правило, в состоянии, далеком от термодинамического равновесия.
Это свойство материальных систем позволило в свою очередь определить целый ряд новых свойств материи.
Вот некоторые из них.
· все процессы необратимы, так как они всегда сопровождаются потерями энергии;
· энтропия S в открытых системах имеет две составляющие: deS – характеризует обмен энтропией с внешним миром; diS – характеризует необратимые процессы внутри;
· материя обладает свойством самоорганизации.
Исследования И. Пригожиным живой материи как открытых материальных систем были в основном сосредоточены на сравнительном анализе организации структур живой и неживой материи, термодинамическом анализе реакций гликолиза и ряде других работ.
Любую часть окружающего нас мира, которую мы хотим исследовать и
описать с позиций термодинамики, называют системой. В качестве примера
интересующих нас термодинамических систем можно назвать клетку,
митохондрию, сердце, организм, биосферу. Следует, однако, отметить, что
методы термодинамики применимы только к макроскопическим системам,
состоящим из большого числа частиц. Живой организм в целом система открытая.
Первые попытки доказательства справедливости первого закона термодинамики для биологии были предприняты еще в XVIII веке и заключались в том, что живой организм изолировали от окружающей среды, измеряли количество выделенного им тепла и сравнивали эту величину с тепловым эффектом биохимических реакций внутри организма. С этой целью в 1780 г. Лавуазье и Лаплас помещали морскую свинку в ледяной калориметр и измеряли количество выделенного тепла и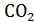 . После этого определяли количество тепла, выделяющееся при прямом сжигании до
. После этого определяли количество тепла, выделяющееся при прямом сжигании до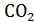 исходных продуктов питания. В обоих опытах были получены величины близкого порядка, что указывало на полную эквивалентность химической энергии, освобождающейся в организме в ходе обмена веществ, и тепловой энергии, выделяемой организмом во внешнюю среду.
исходных продуктов питания. В обоих опытах были получены величины близкого порядка, что указывало на полную эквивалентность химической энергии, освобождающейся в организме в ходе обмена веществ, и тепловой энергии, выделяемой организмом во внешнюю среду.
Метод Лавуазье и Лапласа, получивший название метода непрямой калориметрии, основывается на том факте, что нормальное потребление 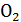 и выделение
и выделение 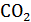 в организме теплокровного животного тесно коррелирует с теплопродукцией. Для иллюстрации можно рассмотреть пример окисления углеводов:
в организме теплокровного животного тесно коррелирует с теплопродукцией. Для иллюстрации можно рассмотреть пример окисления углеводов:
C6H12O6 +602 = 6CO2 +6H20 + 678 ккал.
(180 г) (134,4 л)
Уравнение показывает, что утилизация шести молей О2 (1 моль газа занимает объем 22,4 л) или образование шести молей СО2 при окислении 1 моля глюкозы (180 г ) сопровождается выделением 678 ккал тепла. Следовательно, потребление 1 л O2 или выделение 1 л СО2 сопровождается выделением 5,047 ккал тепла (678:134,4). Эта величина носит название калорический коэффицент.
Применимость первого закона термодинамики к живым системам была
продемонстрирована также в начале двадцатого века Рубнером. В серии работ с микроорганизмами Рубнер показал, что энергия, поступающая в бактерии с пищей, разделяется в процессе потребления на две части:
1) выделяющуюся в среду в виде тепла и энергии, содержащейся в продуктах жизнедеятельности;
2) запасаемую в клеточном материале. Сумма этих двух частей равна внутренней энергии поступающей из пищи. Аналогичные экспериментальные подтверждения первого начала термодинамики были получены Этуотером при изучении теплового баланса человека с помощью калориметра, представляющего собой изолированную камеру, куда помещался человек.
Во всем мире калории считают по системе, предложенной в конце XIX века американским химиком Уилбуром Олином Этуотером (1844--1907), который составил таблицы энергетической ценности продуктов. Он рассчитывал число калорий, сжигая небольшие количества тех или иных продуктов в калориметре и замеряя объем энергии, освободившейся в виде тепла. После этого Этуотер вычислял, сколько энергии использовал организм, отнимая из энергетической ценности калории, которые содержатся в продуктах жизнедеятельности организма: в фекалиях и моче в виде мочевины, аммиака и органических кислот.
Русский химик Гесс Г. И. в 1840 году сформулировал основной закон термохимии, который формулируется так:
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Например, окисление глюкозы в организме осуществляется по очень сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы.
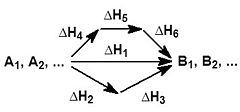

На рисунке приведено схематическое изображение некоторого обобщенного химического процесса превращения исходных веществ А1, А2… в продукты реакции В1, В2…, который может быть осуществлен различными путями в одну, две или три стадии, каждая из которых сопровождается тепловым эффектом ΔHi. Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением:
Δ H 1 = Δ H 2 + Δ H 3 = Δ H 4 + Δ H 5 + Δ H 6
Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты самых разнообразных химических процессов; для этого обычно используют ряд следствий из него.
Изменение тепловой энергии Δ Q изолированной системы пропорционально
абсолютной температуре (Т); коэффициент пропорциональности называется
изменением энтропии (Δ S):
Δ Q = Т Δ S.
Согласно второму закону термодинамики, энтропия изолированной системы возрастает в необратимом процессе и остается неизменной в обратимом процессе. Рост энтропии при самопроизвольных процессах означает переход системы, состоящей из большого числа молекул, в более вероятное состояние. Для характеристики систем, состоящих из большого числа частиц, используется понятие термодинамической вероятности ω. Термодинамическая вероятность равна числу микросостояний, которыми может быть обеспечено данное макросостояние.
Совершенно ясно, что система в каждый данный момент времени вероятнее
всего окажется в состоянии с максимальным ω. И поэтому самопроизвольные процессы будут идти в сторону этого макросостояния.
Сравнительно нетрудно показать, что между величиной ω и энтропией
существует соотношение
S = k ln ω,
где k — постоянная Больцмана.
Это соотношение означает, что энтропия есть мера неупорядоченности
системы: стремление энтропии к росту связано с тенденцией системы перейти в состояние с большей термодинамической вероятностью, т.е. менее упорядоченное.
Из второго закона термодинамики следует невозможность превратить при
постоянной температуре тепловую энергию в механическую работу. Работа связана с однонаправленным перемещением тел (зарядов и масс), т.е. с движением всех входящих в данное тело молекул в одном направлении.
Именно поэтому кинетическую энергию летящего тела в принципе можно
целиком превратить в работу. В работу можно превратить электрическую
энергию, представляющую собой однонаправленное движение ионов или
электронов в электрическом поле.
Тепловая энергия обусловлена хаотическим движением частиц, сумма
векторов скорости которых в любом направлении равна нулю. Поэтому кинетическая энергия этого теплового движения частиц не может быть непосредственно использована для работы.
В живых организмах в ходе их роста и развития может происходить увеличение упорядоченности, которое противоречит второму закону
термодинамики. Противоречие это кажущееся.
С одной стороны, понятие энтропии вообще нецелесообразно использовать, когда речь идет о порядке в макроскопическом смысле, скажем, о дифференциации клеток, специализации клеточных структур
и т.д. С другой стороны, организм постоянно совершает работу и растет,
следовательно, общее количество свободной энергии в нем должно
увеличиваться, что на первый взгляд противоречит второму закону
термодинамики. Такой вывод, однако, основан на недоразумении. Свободная
энергия не может увеличиваться лишь в изолированных системах. Ни один
живой организм не является изолированной системой. Организм питается и с
пищей (а растения и со светом) потребляет свободную энергию, которую потом расходует. В полном смысле слова изолированной можно считать систему организм–среда. Внутри такой системы в ее «живой» части, т.е. в организме, свободная энергия может увеличиваться, а энтропия — соответственно уменьшаться, но при непременном условии одновременного его увеличения в неживой части системы. Например, развитие зеленых растений на Земле происходило благодаря увеличению энтропии в системе Солнце–Земля.
Известно, что и в состоянии покоя, и при выполнении работы может происходить рост и развитие организма, но одновременно идет непрерывное
выделение тепла живыми организмами. Эта теплота диссипации представляет собой результат окисления веществ, заключенных в пище, которое сопровождается ростом энтропии, значительно большим, чем снижение энтропии за счет роста организма и дифференцировки его клеток.
Изменение свободной энергии в ходе любого процесса определяет направление этого процесса: он идет в сторону уменьшения G. Например, для гидролиза фосфатной связи в комплексе Мg2+–АТФ при рН 7,0 и 37ºС по схеме
АТФ + Н2O →АТФ + Ф (где Ф — ион фосфорной кислоты) получено значение
Δ G = –30,5 кДж/моль. В реакции АДФ + Н2O →АМФ + Ф, Δ G = 30кДж/моль.
Значительное понижение свободной энергии при гидролизе АТФ и АДФ
побудило биохимиков назвать эти соединения богатыми энергией, или
макроэргическими.
Однако в живой клетке протекает множество реакций, которые
сопровождаются увеличением свободной энергии (Δ G > 0). Например, синтез
пептидной связи при образовании дипептида:
аланин + глицин → аланилглицин
характеризуется Δ G = 17,2 кДж/моль, а фосфорилирование глюкозы при
гликолизе по схеме глюкоза + Ф → глюкозо-6-фосфат + Н2О характеризуется Δ G = 13,4 кДж/моль.
Эти процессы не могут идти самопроизвольно, они протекают за счет
сопряжения с другими химическими реакциями, изменение свободной энергии которых отрицательно. Объединив первую и последнюю реакции, можно записать:
АТФ + глюкоза → АДФ + глюкозо-6-фосфат.
Складывая изменения свободной энергии реакций при их совместном протекании, получаем для фосфорилирования глюкозы с участием АТФ:
Δ G = –30,5 кДж/моль +13,4 кДж/моль = –17,1 кДж/моль.
 2014-02-24
2014-02-24 931
931






