Энергия смешения бинарного регулярного раствора в теории Гильдебранда определяется следующим образом:
Δ UV = φ1φ2 Vm (δ1 — δ2)2,
где φ1 и φ2 — объемные доли компонентов 1 и 2; δ1 и δ2 — параметры растворимости компонентов 1 и 2; Vm — молярный объем раствора.
Очевидно, что Δ UV >0. Следовательно, потенциал смешения будет иметь положительные значения
Δ GVE ≈ Δ HVE ≈ Δ UVE.
Обычно отклонение экспериментальных значений Δ GVE от расчетных по теории регулярных растворов для систем с неполярными компонентами не превышают 0.1 RT — 0.2 RT.
Расчет параметров растворимости усложняется, если в растворе присутствуют полярные молекулы. В этом случае степень отклонения термодинамических характеристик раствора от идеального увеличивается. Степень неидеальности различных углеводородов (с одинаковым числом углеродных атомов) изменяется следующим образом: алканы > циклоалканы > алкилбензолы > алкилнафталины. В такой же последовательности возрастают значения энергий взаимодействия и параметров растворимости.
Рассмотрение взаимодействия высоко- и низкомолекулярных компонентов нефтяных систем возможно в рамках теории Флори–Хаггинса. Согласно этой теории, потенциал самопроизвольного смешения Δ Gm системы низкомолекулярный компонент (1) – высокомолекулярный компонент (2) с образованием раствора определяется следующим образом:
Δ Gm = RT (x 1lnφ1 + x 2lnφ2) + x 1φ2χ12,
где x 1 и x 2 – мольные доли компонентов 1 и 2; φ1 и φ2 – объемные доли компонентов 1 и 2; χ12 – эмпирический параметр Флори–Хаггинса, определяющий термодинамическое качество растворителя.
Наиболее тщательно теория проверялась для смесей алканов, в которых параметр χ12 характеризует различие в энергиях взаимодействия СН3- и СН2-групп. Модель Флори–Хаггинса оказалась весьма плодотворной для описания процесса осаждения асфальтенов н -алканами из растворителей типа бензола, толуола, хлороформа. В данном случае имеется в виду взаимодействие между способной к растворению дисперсной фазой нефтяной системы и дисперсионной средой, или растворителем. Приближение Флори–Хаггинса позволяет прогнозировать тип критической температуры расслоения (растворения) в системе.
Наряду с нефтяными растворами с полностью смешивающимися компонентами в практике нефтепереработки известны нефтяные растворы, склонные к расслоению при критических условиях. На рис. 5 показана критическая область в модельной системе парафин–8-оксихинолин.
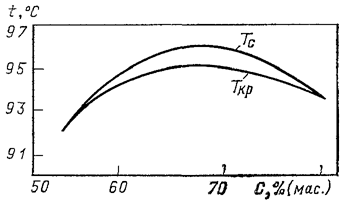
|
| Рис. 5. Диаграмма фазового состояния системы парафин–8-оксихинолин (по оси абсцисс отложена концентрация 8-оксихинолина): Т с — кривая температур начала помутнения гомогенного раствора; Т кр — кривая критических температур расслоения раствора на две микрофазы. |
 2014-02-09
2014-02-09 701
701







