Способы ионизации
Вплоть до 1980-х электронная ионизация (EI) была основным способом ионизации для анализа масс. Однако EI ограничивается малыми молекулами, масса которых намного ниже массы большинства биоорганических соединений.
Это ограничение побудило разработать другие способы ионизации –бомбардировку быстрыми атомами/ионами (FAB), лазерную ионизацию из матрицы (MALDI) и ионизацию электроспрея. Эти способы совершили революцию в биомолекулярном анализе, особенно для больших молекул.
Таблица 2. Способы ионизации
| Способ ионизации | Аббревиатура | События |
| Ионизация электроспрея | ESI | испарение заряженных капель |
| Ионизация наноэлектроспрея | nanoESI | – |
| Химическая ионизация при атмосферном давлении | APCI | коронный разряд и перенос протона |
| Лазерная десорбция/ионизация из матрицы | MALDI | поглощение фотона/перенос протона |
| Десорбция/ионизация на кремнии | DIOS | десорбция иона/перенос протона |
| Бомбардировка быстрыми атомами/ионами | FAB | пучок ионов |
| Электронная ионизация | EI | пучок электронов/перенос электрона |
| Химическая ионизация | CI | перенос протона |
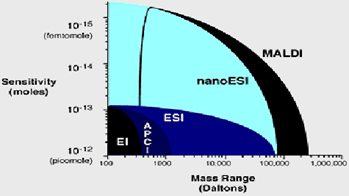
MALDI и ESI сейчас являются самыми распространёнными способами ионизаций для биомолекулярной масс-спектрометрии, с их превосходными диапазонами масс и чувствительностью (рис. 1).
Ионизация электроспрея (ESI)
Суть ESI заключается в следующем. Ионизация частиц происходит при создании тонкого спрея сильно заряженных капель. Раствор распыляется из области с сильным электрическим полем (700 …5000 В) на конце металлической форсунки (игла, капилляр).
Этот метод обычно применяется для пептидов, белков, углеводов, синтетических полимеров и липидов.
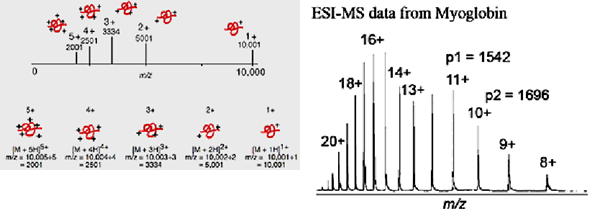
При ионизацияи электроспрея образуются единично заряженные малые молекулы или многократно заряженные большие молекулы, т.е. Многократная зарядка делает возможным наблюдать очень большие молекулы.
Например, белок с массой 10000 дальтон и его масс-спектр с зарядами до +5 показаны на рис.Механизм ионизации белка − протонирование, что не только добавляет заряд, но также увеличивает массу белка на число добавленных протонов. Масса белка и отношение m/z меняется в зависимости от числа зарядов на белке. Подобные закономерности характерны и для других процессов катионизации, например, с Na+ и Cs+.
Растворители для электроспрея
Растворители в ESI выбираются в зависимости от растворимости исследуемых соединений, летучести растворителя и способности растворителя к отдаче протона. Обычно, основными являются протонные растворители – метанол, 50/50 метанол/вода или 50/50 ацетонитрил/вода. Некоторые апротонные сорастоврители, например, 10% ДМСО в воде, изопропиловый спирт, используются для улучшения растворимости некоторых соединений.
Вода редко используется в ESI, т.к. имеет относительно низкое давление насыщенного пара. Лучшая чувствительность получается при добавлении летучего органического растворителя. Ионы Na+, K+, фосфаты и др. соли снижают давление пара капель, что ведет к ослаблению сигнала.
Ионизация наноэлектроспрея (nanoESI)
Электроспрей низкого потока, впервые описанный Вильмом и Манном, назвали наноэлектроспреем, наноспреем и микроэлектроспреем. Такой способ ионизации является вариацией ESI, в которой игла спрея сделана очень маленькой и расположена близко к входу в масс-анализатор. Конечным результатом такой простой корректировки становится увеличение эффективности, которое включает уменьшение необходимого количества образца.
Скорости потока для nanoESI обычно составляют от десятков до сотен нанолитров в минуту. Чтобы получить такие малые скорости потока, nanoESI использует источники из вытянутого и, в некоторых случаях, металлизированного стекла или плавленого кварца с малым входным отверстием (~ 5 мкм). Растворённый образец вносится в источник и к его концу прикладывается давление порядка 2 атм. Вытекание образца с очень малой скоростью позволяет достигать высокой чувствительности. Также, источники расположены очень близко к входу в масс-анализатор, поэтому перенос ионов в масс-анализатор намного более эффективен.
Например, анализ 5 mM раствора пептида при помощи nanoESI займёт одну минуту, употребив ~50 фемтомоль образца. Такой же эксперимент с обычным ESI за то же время израсходует 5 пикомоль, т.е. в 100 раз больше, чем nanoESI. К тому же, так как капли для nanoESI обычно меньше, чем для обычного ESI, необходимое для образования ионов испарение намного меньше. Следовательно, nanoESI менее чувствительно к солям и другим примесям, т.к. меньшее испарение означает, что примеси не будут концентрироваться так сильно, как при ESI.
Химическая ионизация при атмосферном давлении (APCI)
APCI – способ ионизации, при котором ионы генерируются непосредственно из раствора. APCI-устройстве имеется горячий испаритель, который обеспечивает быстрое испарение незаряженных капель анализируемого вещества (аналита). Далее молекулы образца в паре проходят через зону ионно-молекулярной реакции при атмосферном давлении.
В APCI ионизация аналита происходит при взаимодействии с ионами растворителя, который в свою очередь, ионизируется коронным разрядом.. При этом способе ионизации образуются только положительные +1 или отрицательные –1 молекулярные ионы и практически не происходит фрагментация (распад молекул). Давление газа уменьшает фрагментацию во время ионизации и ведет к образованию практически только нетронутых молекулярных ионов.
Фотоионизация при атмосферном давлении (APPI)
Фотоионизация при атмосферном давлении (APPI) стала сейчас важным способом ионизации, потому что она генерирует ионы непосредственно из раствора с относительно малым фоновым сигналом и способна к анализу относительно неполярных соединений. Так же, как и APCI, поток жидкости для APPI вводится прямо в устройство ионизации.
Основное различие между APCI и APPI состоит в том, что в APPI парообразный образец облучается УФ-светом (обычная криптоновая лампа испускает от 10…10,6 эВ). Часто APPI является намного более чувствительным, чем ESI или APCI и показывает более высокое соотношение сигнал/шум из-за более низкой ионизации фона.
Недостатком ESI и APCI является также то, что они образуют фоновые ионы растворителей. Кроме того, в ESI идут процессы подавления ионов, а APCI требует испарения при температурах 350…500°C, что может вызвать термическое разложение.
Лазерная десорбция/ионизация из матрицы (MALDI)
Масс-спектрометрия с лазерной десорбцией/ионизацией в матрице (MALDI-MS) впервые была использована в 1988 году Танакой, Карасом и др. С тех пор метод стал широко использоваться для анализа пептидов, белков и большинства других биомолекул. Эффективный и направленный перенос энергии во время акта индуцированной лазером десорбции приводит к большому выходу ионов незатронутого аналита.
 Хотя точный механизм процесса неизвестен, считается, что MALDI вызывает ионизацию и перевод образца из конденсированной фазы в газовую посредством лазерного возбуждения и индивидуализации молекул образца из матрицы.
Хотя точный механизм процесса неизвестен, считается, что MALDI вызывает ионизацию и перевод образца из конденсированной фазы в газовую посредством лазерного возбуждения и индивидуализации молекул образца из матрицы.
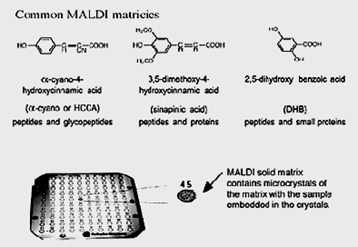
В MALDI аналит сначала сокристаллизуется с большим молярным избытком матричного соединения, обычно УФ-поглощающей слабой органической кислотой. Облучение такой смеси аналита с матрицей лазером приводит к испарению матрицы, которая несёт аналит в себе. Матрица играет ключевую роль в этом методе. Сокристаллизованные молекулы образца также испаряются, но без прямого поглощения энергии лазера. Органические молекулы, чувствительные к лазерному излучению, защищены от прямого возбуждения УФ-лазером.
Матрица MALDI – нелетучий твёрдый материал, обеспечивающий процессы десорбции и ионизации посредством поглощения лазерного излучения. Как результат, и матрица, и любой образец, встроенный в неё, испаряются. Матрица также служит для того, чтобы минимизировать ущерб образцу от лазерного излучения, поглощая большую часть падающей энергии.
Десорбированные заряженные молекулы в газовой фазе затем электростатически направляются из MALDI-устройства ионизации в масс-анализатор.
Ценность MALDI для анализа биомолекул основана на её способности давать информацию о молекулярной массе неповреждённых молекул. Способность давать точную информацию может быть чрезвычайно важна для определения и характеристики белков. Например, белок часто может быть однозначно определён точным анализом масс составляющих его пептидов (полученных химическим или же ферментативным воздействием на образец).
| Таблица 3. Преимущества и недостатки метода лазерной десорбции/ионизации в матрице (MALDI). | ||||||||||||
|
Приготовление образца и матрицы оказывает значительное влияние на качество масс-спектров MALDI белков и пептидов. Среди большого разнообразия известных методов приготовления наиболее часто употребляемым является метод высушенной капли. В этом случае насыщенный раствор матрицы смешивается с раствором аналита так, чтобы соотношение матрицы к аналиту было около 5000:1. Аликвота (0,5-2,.0 мкл) такой смеси затем помещается на место образца и высушивается.
 |
Также образцы могут быть приготовлены последовательным способом. В тонкослойном методе сначала на цель наносится гомогенная «плёнка» матрицы, а затем туда добавляется образец, который абсорбируется ею. Этот метод даёт хорошую чувствительность, разрешающую способность и точность определения.
В варианте толстослойного метода в качестве подложки к мАтрице используется нитроцеллюлоза (NC) После образования единого слоя NC-матрица к нему добавляется образец. Этот метод приготовления предотвращает образования щелочных аддуктов и значительно увеличивает чувствительность определения, особенно для пептидов и белков, экстрагированных из гелей.
Десорбция/ионизация на кремнии (DIOS)
DIOS – свободный от матрицы метод, который использует импульсную десорбцию/ионизацию на кремнии. Поверхности структурированного пористого кремния или кремниевого нановолокна являются УФ-поглощающими полупроводниками с большой площадью поверхности (сотни м2/см3).
Строение структурированного кремния обеспечивает каркас для накопления молекул растворителя и аналита, а поглощение УФ даёт механизм для передачи энергии лазера аналиту. Такая удачная комбинация свойств позволяет DIOS быть применимым для большого разнообразия биомолекул, включая пептиды, углеводы и небольшие органические соединения различных типов. В отличие от других прямых безматричных методов десорбции DIOS позволяет проводить десорбцию/ионизацию с малым разложением аналита или вообще без него.
Длина волны лазера (337 нм), обычно применяемая в MALDI, подходит и для DIOS. Хотя DIOS сравним с MALDI в отношении чувствительности, у него есть несколько преимуществ из-за отсутствия мешающей матрицы: низкий фон на малых диапазонах массы, размещение водных образцов, упрощённая подготовка образцов.
Бомбардировка быстрыми атомами/ионами (FAB)
Бомбардировка быстрыми атомами/ионами, или FAB – метод ионизации, похожий с MALDI, так как в нём используется матрица и пучок высокоэнергетических частиц для десорбции ионов с поверхности. Отличие состоит в том, что в MALDI, энергетический пучок представляет собой импульсный лазерный свет, а в FAB использует непрерывный пучок ионов. В MALDI матрица обычно твёрдая кристаллическая, а в FAB обычно использует жидкую матрицу. FAB примерно в 1000 раз менее чувствителен, чем MALDI.
Бомбардировка быстрыми атомами – мягкий способ ионизации, в котором используется прямое введение зонда для подачи образца, пучок нейтральных атомов Xe или ионов Cs+ для распыления и ионизации частиц образца и матрицы с поверхности зонда.
Обычно в FAB-спектре обнаруживаются ионы протонированные или катионизированные матрицы (M+Na+) и молекулярные ионы аналита.
Матрица FAB – нелетучая жидкость, которая служит для постоянного восполнения поверхности новым образцом по мере того, как он бомбардируется пучком ионов. Поглощая большую часть падающей энергии, матрица также минимизирует разложение образца из-за высокоэнергетических частиц образца.
Две наиболее часто употребляющихся матрицы для FAB – м-нитробензиловый спирт и глицерин.
 |
 |
Электронная ионизация (EI)
Электронная ионизация – один из наиболее используемых способов ионизации для повседневных анализов малых гидрофобных термически стабильных молекул (М < 400 дальтон). Электронная ионизация не применяется для соединений с большой молекулярной массой, потому что необходимая термическая десорбция образца ведёт к температурному разложению до того, как происходит испарение.
EI обычно даёт большое число фрагментарных ионов и считается «жёстким» способом ионизации. Однако, фрагментарная информация также может быть очень полезной. Например, используя базы данных, содержащие свыше 200000 масс-спектров электронной ионизации, возможно определить неизвестное соединение в течение нескольких секунд, если оно есть в базе данных. Эти базы (например, база NIST) позволяют быстро идентифицировать малые молекулы.
В устройстве электронной ионизации образец должен поставляться в газообразной форме, что осуществляется «выкипанием» образца посредством термической десорбции или введением газа через капилляр. Капилляр часто является выходом капиллярной колонки прибора газовой хроматографии. В этом случае капиллярная колонка обеспечивает разделение (это также известно как газовая хромат-масс-спектрометрия – GC/MS). Десорбция твердых или жидких образцов производится нагреванием в вакууме масс-спектрометра. После перехода в газовую фазу соединения переносятся в устройство электронной ионизации, где электроны возбуждают молекулу, тем самым вызывая ионизацию отрывом электрона и фрагментацию.
Принципиальными проблемами, связанными с термической десорбцией при электронной ионизации являются 1) нелетучесть больших молекул, 2) термическое разложение, 3) избыточная фрагментация.
Механизм отрыва электрона при образовании положительного иона осуществляется следующим образом:
Образец термически испаряется.
Электроны испускаются нагретым катодом и ускоряются электрическим полем.
Молекулы образца проходят через пучок электронов.
Электроны с кинетической энергией 70 эВ передают часть своей энергии молекулам. Эта передача вызывают ионизацию (отрыв электрона) так, что ион сохраняет обычно не более 6 эВ избыточной энергии.
Избыток внутренней энергии (6 эВ) в молекуле ведёт к некоторой фрагментации.
Химическая ионизация (CI)
Химическая ионизация (CI) применяется к образцам, сходным с анализируемыми при помощи EI, и обычно применяется, чтобы увеличить долю молекулярного иона. Химическая ионизация использует газофазные ионно-молекулярные реакции в вакууме масс-спектрометра для получения ионов из молекул образца. Процесс химической ионизации инициируется газом-реагентом, таким, как метан, изобутан или аммиак, который ионизируется электронным ударом. Высокое давление газа в устройстве ионизации приводит к ионно-молекулярным реакциям между ионами газа-реагента и его нейтральными молекулами. Некоторые продукты ионно-молекулярных реакций могут реагировать с аналитом с образованием ионов.
Возможные механизмы ионизации при CI:
Реагент (R) + e- → R+ + 2 e-
R+ + RH → RH+ + R
RH+ + Аналит (A) → AH+ + R
В отличие от EI, аналит с большей вероятностью образует молекулярный ион с меньшей фрагментацией при использовании CI. Однако, аналогично EI, образцы должны быть термически стабильными, так как испарение в CI-устройстве осуществляется при помощи нагревания.
 2014-02-09
2014-02-09 4359
4359
