Молекулы
Молекулярно-кинетическая теория
Если не считать умозрительных наивных атомистических систем древних, современные представления о молекулах и атомах зародились в исследованиях химиков. Они в свое время обратили внимание на то, что в химических реакциях, в которых реагенты взаимодействуют без остатка, их массы находятся в кратных некоторым числам отношениях. Эти наблюдения подтолкнули исследователей к догадке, что вещества в химических реакциях взаимодействуют некоторыми малыми неделимыми порциями с массой, характерной для данного вещества. Наименьшую порцию вещества, сохраняющую его химические свойства, назвали молекулой.
Задача 1. Азот может образовывать с кислородом пять различных соединений. Так, 7 г азота, соединяясь без остатка с:
1 ∙ 4 г кислорода, дают 11 г закиси азота,
2 ∙ 4 г кислорода, дают 15 г окиси азота,
3 ∙ 4 г кислорода, дают 19 г азотистого ангидрида,
4 ∙ 4 г кислорода, дают 23 г двуокиси азота,
5 ∙ 4 г кислорода, дают 27 г азотного ангидрида.
а) Как относятся друг к другу массы молекул азота и кислорода?
б) Объясните кратные отношения масс содержащегося в соединениях кислорода на основе представлений об атомах и молекулах. Напишите химические формулы перечисленных соединений.
в) В домолекулярных представлениях предполагалось, что любое вещество безгранично делимо. Сформулируйте противоречие, в котором находится это предположение с экспериментальным фактом существования только пяти соединений азота с кислородом.
Решение. Представления об атомах и молекулах в действии.
б) Предположим, что молекула соединения содержит x атомов азота и y атомов кислорода. Пусть mxy - масса молекулы закиси азота, mx - масса молекулы азота, my - масса молекулы кислорода, Mxy - масса соединения, Mx - масса азота, входящего в соединение, My - масса кислорода, входящего в соединение. Число молекул соединения, содержащегося в массе Mxy, равно Mxy/mxy. Из определения чисел х и y следует, что
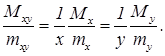 (1)
(1)
Из последнего равенства находим отношение x/y:
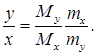 (2)
(2)
Учитывая, что mx = 14 а.е.м., my=16 а.е.м., находим:
для закиси азота 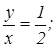 для окиси азота
для окиси азота 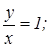 для азотистого ангидрида
для азотистого ангидрида 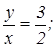 для двуокиси азота
для двуокиси азота 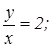 для азотного ангидрида
для азотного ангидрида 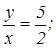 .
.
Условия задачи и проведенные рассуждения дают отношение y/x, поэтому данные задачи позволяют определить химическую формулу со стехиометрическими показателями с точностью до постоянного множителя. Возможные химические формулы: закись азота - N2O или N4O2,или...; окись азота - NO или N2O2, или...; азотистый ангидрид - N2O3 или N4O6,или...; двуокись азота NO2, или N2O4,или...; азотный ангидрид - N2O5, или N4O10,или....
в) В предположении о безграничной делимости вещества элементы могли бы соединяться в любых весовых отношениях, поэтому соединений азота с кислородом должно было бы быть бесконечное множество. Предположение о безграничной делимости не позволяет объяснить конечность числа возможных соединений азота и кислорода.
Из молекулярных представлений следует, что если брать порции некоторого наперед заданного числа молекул, то отношения масс порций разных веществ будет равно отношению масс молекул.
Количество вещества, масса которого составляет число граммов, равное молекулярному весу этого вещества, называется граммолекулой или молем. Число молекул в моле равно числу Авогадро No=6.025×1023 моль-1.
[Число молекул, содержащихся в одном моле вещества (число Авогадро) впервые определил Жан Перрен при изучении распределения по высоте плотности броуновских частиц в жидкости. Идея опытов Перрена будет обсуждена позднее при изучении распределения Больцмана.]
Закон Авогадро говорит о том, что равные количества газообразного вещества, выраженные в молях, занимают равные объемы при одинаковых температурах и одинаковых давлениях, или - в равных объемах газов при одинаковых условиях содержится равное число молекул. При 0oС и давлении 760 мм рт. ст. один моль газа занимает 22,4 л.
 2014-02-09
2014-02-09 1079
1079







