Классическая и квантовая теория теплоемкости газов.
Классическая теория основана на предположении, что к атомно-молекулярным системам применимы законы классической механики.
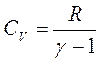
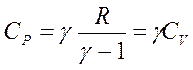
1.1 Одноатомные газы.
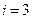
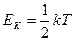
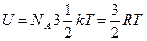
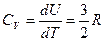
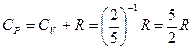
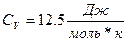
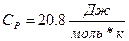
 теория
теория
Практика
| Газ | Т(k) |  g g |
| Hg | 1.666 | |
| He | 1.660 | |
| He | 1.670 | |
| Ne | 1.640 | |
| Ar | 1.650 | |
| Ar | 1.690 |
1.2 Двухатомный газ.
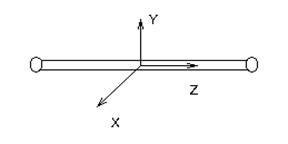
Жёстко! i=5
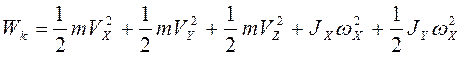
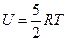

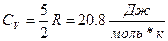
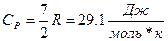
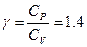
Эксперимент
| Газ | Т |  g g |
| H2 | 1.407 | |
| N2 | 1.398 | |
| N2 | 1.419 | |
| O2 | 1.398 | |
| O2 | 1.411 | |
| O2 | 1.404 |
Хуже!
Ещё хуже практика согласуется с теоретическими результатами для трёх и более атомных газов.
1.3 Теплоёмкость твёрдых тел.
Кристаллическая решётка + электронный газ.
Узлы решётки колеблются 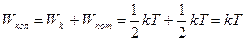
Все атомы одинаковы Þ колебательных 3 степени свободы
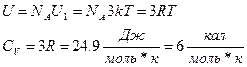
1819 Дьюлонг (1785-1838) и Пти (1791-1820)
произведение удельной теплоёмкости химического элемента в твёрдом состоянии на его атомную массу одинаково для всех элементов и составляет около 3R.
C * m = Cоnst = 3R
Закон Джоуля-Коппа 1864.
Молярная теплоёмкость твёрдого соединения равна сумме молярных теплоёмкостей элементов из которых оно состоит.
1.4 Недостатки классической теории теплоёмкости.
1. Не даёт объяснения зависимости С от Т.
2. Непоследовательность: н-р двухатомная молекула и твёрдое тело (атом не точка!) i = 3+3 = 6, если атомы рассматривать как твёрдые тела, то i = 12. Атомные системы представляются (моделируются) как макро системы с наложенными связями.
3. Для металлов С = 3R, электронов газ. Его С не учитывается. Но по теории она должна была быть равной теплоёмкости решётки. Опыт –свободные электроны не вносят никакого вклада в теплоёмкость металлов.
4. Опыт –эффективный вклад в теплоёмкость вносят не все, а только некоторые степени свободы.
1. Может принимать лишь дискретные значения.
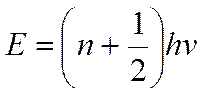
v – частота осциллятора
n = 0,1,2,3, …
h = 6,626176*10-34Дж*С
2. Пусть кТ £ hv. Газ =S гармонических осцилляторов. Здесь должны происходить нулевые колебания и Ек ¹ 0, тогда как классическая теория совсем исключает их (считая молекулу абсолютно жёсткой). Энергия нулевых колебаний не зависит от температуры. С ростом Т начинают возбуждаться первый и более высшие энергетические уровни.
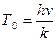 - характеристическая температура
- характеристическая температура
H2 T V = 6000 K
3. Вращение молекул
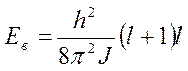
J=mr2
l = 0,1,2,3,…(n-1)
l = 0 Eв = 0
l = 1 
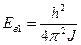
Если kT << Eв1 то теплоёмкость можно вычислять не учитывая вращение молекул.
Если kT << Eв1 то уже дискретность уровней энергии слабо связывается и применима классическая теория.
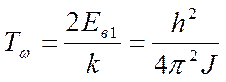
- характеристическая температура.
4. Дискретность энергетических уровней не совместима с классической теоремой о равнораспределении молекул по степеням свободы.
 2014-02-09
2014-02-09 3141
3141






