В системах, содержащих две и более фаз, как например газ и твердое вещество, раствор и осадок, относительная концентрация вещества в чистой твердой фазе остается постоянной, и равной 1. Если на дне стакана с раствором имеется кристаллическая соль, то по мере ее растворения масса кристаллов уменьшается, но концентрация соли в самих кристаллах остается постоянной. Поэтому насыщенный раствор соли (что соответствует состоянию равновесия раствор – осадок) имеет концентрацию, не зависящую от массы осадка.
Постоянная концентрация вещества в твердой фазе, равная 1, в выражение П с и K не входит. Распространенным примером гетерогенных процессов является растворение малорастворимых солей и выпадение осадков из растворов:
 СаСО3(кр) Са2+ + СО32- прямая реакция растворение
СаСО3(кр) Са2+ + СО32- прямая реакция растворение
 Са2+ + СО32- СаСО3¯ обратная реакция осаждение
Са2+ + СО32- СаСО3¯ обратная реакция осаждение
K пр = 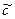 (Ca2+)×
(Ca2+)×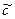 (CO32-);
(CO32-); 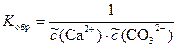
 2014-02-09
2014-02-09 604
604







