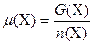 ;
; 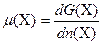
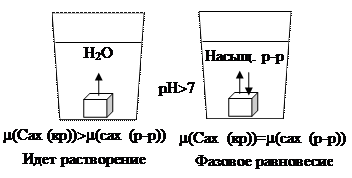
Химический потенциал не дается в справочных таблицах. Он служит для доказательств.
Химический потенциал вещества в растворе зависит от концентрации:
m(Х) = m°(Х) + RT ln c (X)
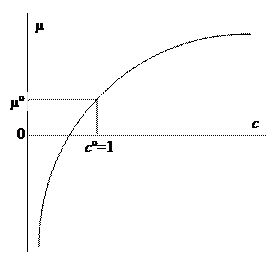
Это уравнение эвристическое, предложенное логическим путем для идеальных растворов. С ним возникает не мало сложностей. Далее вспомним об этом, когда в теории растворов будет введена активность вместо концентрации. При малых концентрациях m становится отрицательным, при больших – положительным (логарифмический график). Значение m° относится к стандартной концентрации с °= 1 моль/л.
Концентрация под знаком логарифма относительная:
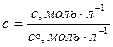
Применяем химический потенциал к вычислению D rG:
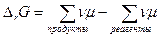
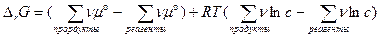
Первое слагаемое обозначаем как DG°, так как оно соответствует концентрациям равным 1, а второе по правилам преобразования логарифмов превращается в логарифм отношения произведений:
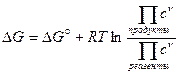 . (1)
. (1)
Полученное уравнение называется уравнением изотермы химической реакции. При концентрациях всех веществ с =1 значение D rG = D rG °. Вспомните, это было: стандартное изменение энергии Гиббса относится к концентрациям, равным 1. Все выражение под логарифмом далее будем коротко обозначать «П с». В учебниках встречается название произведение реакции. Пусть полученное уравнение не потрясает вас своей сложностью. Для конкретных реакций получаются вполне простые и краткие выражения.
 2NO2 N2O4. D rG = D rG ° + RT
2NO2 N2O4. D rG = D rG ° + RT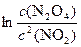
В случае реакций с участием газов, для последних вместо концентраций применяются парциальные давления:
O2(г) + Hb(aq) = HbO2(aq)
D rG = D rG ° + RT ln(с (HbO2)/ с (Hb)× p (O2))
 2014-02-09
2014-02-09 532
532








