Для описания поведения газов в широком интервале плотностей было предложено много различных уравнений. Самым простым из них и вместе с тем дающим достаточно хорошие результаты оказалось уравнение Ван-дер-Ваальса. Это уравнение получено путем внесения поправок в уравнение (1)
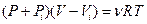 . (2)
. (2)
1) Из-за взаимного притяжения между молекулами газ как бы сжимается большим давлением, чем давление Р, оказываемое на газ стенками сосуда, в котором он заключен. Поправка Рi характеризует ту добавку к внешнему давлению, которая обусловлена взаимным притяжением молекул друг к другу. Заметные воздействия молекул друг на друга осуществляется в пределах небольших расстояний, называемых радиусом молекулярного действия. Сила взаимного притяжения двух элементарных объемов, имеющих радиусы порядка этого радиуса, пропорциональна как числу молекул, заключенных в одном из объемов, так и числу молекул, заключенных в другом объеме. Каждое из этих чисел в свою очередь пропорционально числу молекул в единице объема, т.е. обратно пропорционально объему газа. Этими соображениями можно пояснить то обстоятельство, что поправка к давлению имеет вид:
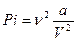 ,
,
где а – постоянная.
2) Вследствие того, что молекулы обладают конечным объемом, пространство, доступное для движения молекул, оказывается меньшим, чем объем сосуда V. Поправка к объему Vi характеризует ту часть объема, которая недоступна для движения молекул. Она равна по порядку величины нескольким суммарным объемам молекул, и пропорциональна количества вещества n:
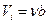 ,
,
где b – еще одна постоянная.
Тогда уравнение Ван-дер-Ваальса для данной массы газа примет вид:
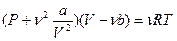 , (3)
, (3)
где a и b – константы Ван-дер-Ваальса, имеющие для разных газов различные значения, определяемые опытным путем (см. табличные значения). Если давление выражено в паскалях, а объем в м3, то константа a измеряется в Па×м6/моль2, а константа b – в м3/моль. Можно ввести константы Ван-дер-Ваальса для данной массы газа:
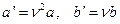 ,
,
Насколько уравнение Ван-дер-Ваальса лучше передает поведение газов, чем уравнение (1) можно судить по данным, приведенным в таблице. В третьем столбце таблицы даны значения величины 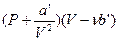 для той же массы азота, для которой даны во втором столбце значения PV. Как видно из таблицы, уравнение Ван-дер-Ваальса (3) гораздо лучше согласуется с экспериментом, чем уравнение (1).
для той же массы азота, для которой даны во втором столбце значения PV. Как видно из таблицы, уравнение Ван-дер-Ваальса (3) гораздо лучше согласуется с экспериментом, чем уравнение (1).
В соответствии с тем фактом, что все реальные газы с уменьшением плотности приближаются по своим свойствам к идеальному газу, уравнение Ван-дер-Ваальса в пределе, при стремление объема к бесконечности, переходит к уравнению (1). В этом можно убедится, вынеся в уравнение Ван-дер-Ваальса P и V за скобки:
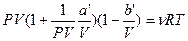
и приняв во внимание, что произведение PV остается примерно постоянным.
 2014-02-10
2014-02-10 429
429








